目次
- がん分子標的薬耐性機構の解明と耐性克服薬の探索
- 血小板との相互作用を介したがん悪性化機構の解明とそれに基づく創薬
- がん免疫療法への耐性機構の解明と克服法の探索
- がん幹細胞(Cancer stem cell)の機能解析と分子標的の同定
- 生存増殖シグナル伝達系の解析と分子標的の探索
血小板との相互作用を介したがん悪性化機構の解明とそれに基づく創薬
がん治療を困難なものとする要因の一つに、がん細胞が他臓器へと浸潤・転移する性質が挙げられます。実際に、がん患者の死因の約90%は遠隔転移によることからも、がん細胞の浸潤・転移機構を理解しその過程を抑制することは、今後のがん治療法開発における重要な課題です。私たちは、がんの血行性転移の成立に重要な役割を果たす血小板に着目し、血小板との相互作用を介したがん悪性化機構の理解と、その制御法に基づく創薬開発を目標に研究を行っています。
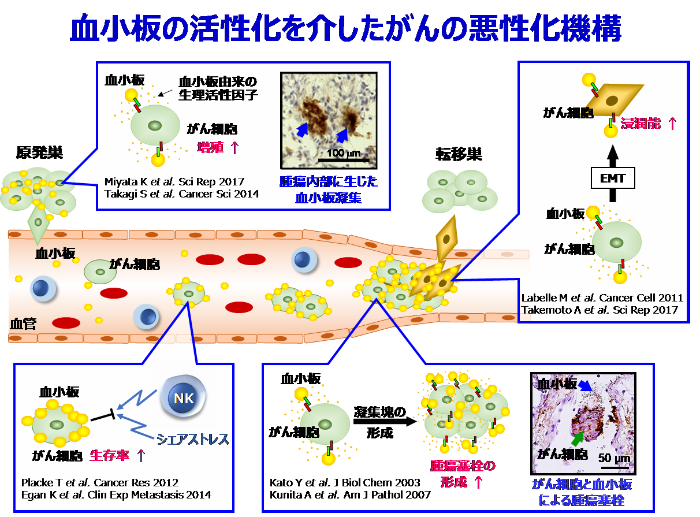
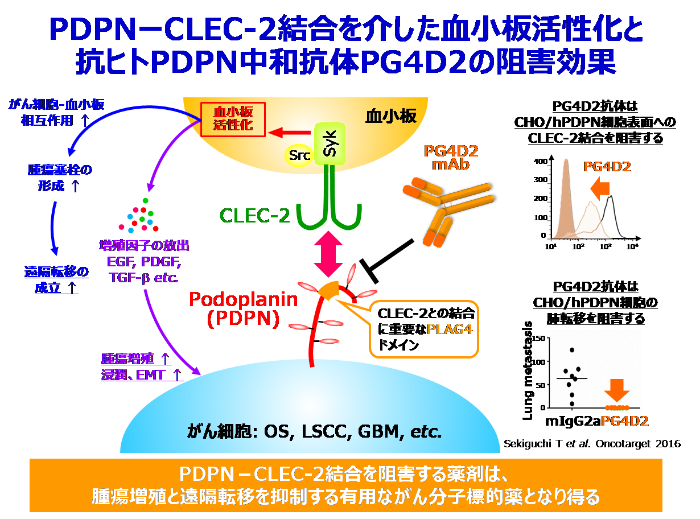
がん細胞が血行性に他臓器へと転移する際、がん細胞は血中で血小板と相互作用することで血小板を活性化し、凝集塊を形成することが知られています。この凝集塊は、血流シェアストレスや免疫細胞の攻撃からがん細胞を保護するとともに、転移先臓器の微小血管に詰まることで転移巣形成の足掛かりになることが知られています。私たちは、高転移性がん細胞の細胞表面に発現する血小板凝集促進因子としてAggrus/Podoplanin (PDPN) の同定に成功しました (当初はAggrusと命名しましたが、その後の解析から当時は機能未知であったリンパ管マーカー分子PDPNと同一分子であることが明らかになりました)。PDPNを低転移性がん細胞に発現させると、高い血小板凝集誘導活性が付与されると共に、マウスモデルにおいて高率に肺転移を来すようになることを報告し、PDPNががんの血行性転移に寄与する血小板凝集促進因子であることを確認しました。また、PDPNは、肺扁平上皮がん、食道がん、膀胱がん、中皮腫、グリオブラストーマ、骨肉腫などで発現亢進が認められ、その発現量と転移傾向や予後の不良さが正相関することも報告しました。さらに、PDPNの血小板凝集誘導活性に重要な一次構造上のドメインを同定し、このドメインを特異的に認識する抗PDPN中和抗体を複数樹立することに成功しました。これらの抗PDPN中和抗体は、カニクイザルやノックインマウスを用いた毒性試験において、病理組織学的検査や血液学的検査により毒性が認められないことも確認しています。この結果を受けて、企業と共同で上記抗体をもとにしたヒト化抗PDPN中和抗体を開発し、がんの血行性転移を抑制可能な抗体医薬品としての臨床応用を目指しています。
また、近年私たちは、活性化された血小板からTGF-β、PDGF、EGF、LPAなどの様々な生理活性物質が放出されることで、がん細胞の増殖、生存、浸潤が亢進することを見出しており、血小板は血行性転移以外の局面においてもがんの悪性化に寄与することを発見しています。血小板との相互作用を介したがん悪性化機構の理解を深化させることで、その制御法に基づく創薬開発へと研究を発展させていきたいと考え、さらなる研究を進めています。
Recent publications:
- Targeting podoplanin for the treatment of osteosarcoma. Takemoto A, Takagi S, Ukaji T, Gyobu N, Kakino M, Takami M, Kobayashi A, Lebel M, Kawaguchi T, Sugawara M, Tsuji-Takayama K, Ichihara K, Funauchi Y, Ae K, Matsumoto S, Sugiura Y, Takeuchi K, Noda T, Katayama R, and Fujita N, Clin Can Res. 2022 in press
- Takagi S, Sasaki Y, Koike S, Takemoto A, Seto Y, Haraguchi M, Ukaji T, Kawaguchi T, Sugawara M, Saito M, Funauchi Y, Ae K, Matsumoto S, Fujita N, Katayama R. Platelet-derived lysophosphatidic acid mediated LPAR1 activation as a therapeutic target for osteosarcoma metastasis. Oncogene. 2021 Sep;40(36):5548-5558.
- Novel knock-in mouse model for the evaluation of the therapeutic efficacy and toxicity of human podoplanin-targeting agents. Ukaji T, Takemoto A, Shibata H, Kakino M, Takagi S, Katayama R, Fujita N. Cancer Sci. 2021 Jun;112(6):2299-2313.
- A safety study of newly generated anti-podoplanin-neutralizing antibody in cynomolgus monkey (Macaca fascicularis). Ukaji T, Takemoto A, Katayama R, Takeuchi K, Fujita N. Oncotarget. 2018 Sep 7;9(70):33322-36.
- Platelet-activating factor podoplanin: from discovery to drug development. Takemoto A, Miyata K, Fujita N. Cancer Metastasis Rev. 2017 Jun;36(2):225-234.
- Podoplanin enhances lung cancer cell growth in vivo by inducing platelet aggregation. Miyata K, Takemoto A, Okumura S, Nishio M, Fujita N. Sci Rep. 2017 Jun 22;7(1):4059.
- A critical role of platelet TGF-β release in podoplanin-mediated tumour invasion and metastasis. Takemoto A, Okitaka M, Takagi S, Takami M, Sato S, Nishio M, Okumura S, Fujita N. Sci Rep. 2017 Feb 8;7:42186.
- Targeting a novel domain in podoplanin for inhibiting platelet-mediated tumor metastasis. Sekiguchi T, Takemoto A, Takagi S, Takatori K, Sato S, Takami M, Fujita N. Oncotarget. 2016 Jan 26;7(4):3934-46.
- Suppression of Aggrus/podoplanin-induced platelet aggregation and pulmonary metastasis by a single-chain antibody variable region fragment. Miyata K, Takagi S, Sato S, Morioka H, Shiba K, Minamisawa T, Takami M, Fujita N. Cancer Med. 2014 Dec;3(6):1595-604.
- Expression of Aggrus/podoplanin in bladder cancer and its role in pulmonary metastasis. Takagi S, Oh-hara T, Sato S, Gong B, Takami M, Fujita N. Int J Cancer. 2014 Jun 1;134(11):2605-14.
- Platelets promote tumor growth and metastasis via direct interaction between Aggrus/podoplanin and CLEC-2. Takagi S, Sato S, Oh-hara T, Takami M, Koike S, Mishima Y, Hatake K, Fujita N. PLoS ONE, 2013 Aug 21; 8(8): e73609.
- The impact of Aggrus/podoplanin on platelet aggregation and tumour metastasis. Fujita N, Takagi S. J Biochem. 2012 Nov;152(5):407-13.
- Prevention of hematogenous metastasis by neutralizing mice and its chimeric anti-Aggrus/podoplanin antibodies. Nakazawa Y, Takagi S, Sato S, Oh-hara T, Koike S, Takami M, Arai H, Fujita N. Cancer Sci. 2011 Nov;102(11):2051-7.