目次
- がん分子標的薬耐性機構の解明と耐性克服薬の探索
- 血小板との相互作用を介したがん悪性化機構の解明とそれに基づく創薬
- がん免疫療法への耐性機構の解明と克服法の探索
- がん幹細胞(Cancer stem cell)の機能解析と分子標的の同定
- 生存増殖シグナル伝達系の解析と分子標的の探索
生存増殖シグナル伝達系の解析と分子標的の探索
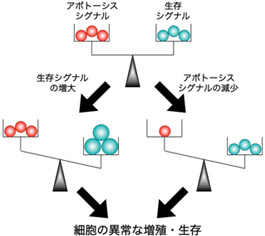 発生過程や正常組織では、細胞の生存と死は厳密に制御されており、このような制御が生体の恒常性維持に重要な役割を果たしている。細胞の生存と死は、細胞に備わっている生存シグナルとアポトーシスシグナルのバランスにより決定されている。がんなどの疾病における細胞の異常増殖・不死化の際には、生存増殖シグナルの異常な活性化が起きている場合が多い。主要な生存増殖シグナル伝達経路であるPI3K-Akt経路に関わる分子は、多くのがんで遺伝子増幅や活性亢進がおきていることが示されている。PI3K-Akt経路は、増殖因子レセプターなどの下流に位置するため、現在臨床で用いられている増殖因子レセプターなどを標的とした分子標的薬剤に対する耐性にも関与している。このPI3K-Akt経路を標的にした薬剤開発が世界中で精力的に進められ、新たな制御分子・基質分子が報告されてきていることから、今後、既存の抗がん剤耐性の克服機能を持ち合わせた新たな作用機序のがん治療法が開発されることが期待されている。
発生過程や正常組織では、細胞の生存と死は厳密に制御されており、このような制御が生体の恒常性維持に重要な役割を果たしている。細胞の生存と死は、細胞に備わっている生存シグナルとアポトーシスシグナルのバランスにより決定されている。がんなどの疾病における細胞の異常増殖・不死化の際には、生存増殖シグナルの異常な活性化が起きている場合が多い。主要な生存増殖シグナル伝達経路であるPI3K-Akt経路に関わる分子は、多くのがんで遺伝子増幅や活性亢進がおきていることが示されている。PI3K-Akt経路は、増殖因子レセプターなどの下流に位置するため、現在臨床で用いられている増殖因子レセプターなどを標的とした分子標的薬剤に対する耐性にも関与している。このPI3K-Akt経路を標的にした薬剤開発が世界中で精力的に進められ、新たな制御分子・基質分子が報告されてきていることから、今後、既存の抗がん剤耐性の克服機能を持ち合わせた新たな作用機序のがん治療法が開発されることが期待されている。
基礎研究部ではこのPI3K-Akt経路とそれに類似したシグナルを伝達するPim経路の活性制御機構の検討を進めてきた。
これまでに、Aktシグナルを阻害する薬剤の探索から、トポテカン(Cancer Res., 2000)・Hsp90阻害剤(JBC, 2002)・UCN-01(Oncogene, 2002)といった抗がん剤がAktシグナルを阻害すること、さらにこれら薬剤の分子標的がAktの上流のキナーゼであるPDK1であり、これら薬剤の抗腫瘍活性にはAktのシグナル伝達阻害が重要な役割を果たしていることを明らかにしている。特にUCN-01とRadicicolの誘導体であるKF58333は、PDK1を抑制するIC50値がnMオーダーと阻害活性の非常に強い化合物であった。また一部の抗がん剤は、カスパーゼ依存的にAktを分解してAktシグナル伝達系を抑制することも見い出している(J. Cell. Physiol., 2000)。このことは、がん細胞の生存にとってAktシグナル伝達系が重要な役割を果たしていることだけでなく、Aktががん化学療法の良い標的となることを実証したものと考えている。また、Aktシグナルの制御機構として、Hsp90が細胞内でAktとPDK1に結合し、その活性維持に関与していること(PNAS, 2000)、Aktにより転写制御されている因子としてTRADDを同定したこと(MCB, 2002)、Aktによる細胞周期進行誘導にWee1Huのリン酸化(MCB, 2005)や、p27Kip1のリン酸化を介した核外排出機構が関与していること(JBC, 2002; JBC, 2003)を見いだしてきた。共同研究の結果ではあるが、アポトーシスを誘導するPAR-4分子がAktによりリン酸化され不活性化される事も見いだしている(Mol. Cell, 2005)。また、Aktの新たな結合分子としてCKIP-1分子(Cancer Res., 2007)、PDK1結合分子としてTUSC4分子(Cancer Sci., 2008)を見いだしている。特にPDK1結合分子として見いだし報告したAki1分子(MCB, 2008)は、その後の解析によりAktにも結合することでPDK1-Aktの足場タンパク質として働いていることを見いだした。さらにAki1は中心体にも局在しており、中心体では中心小体の解離を制御している分子であることが新たに見いだされている(JCB, 2009)。
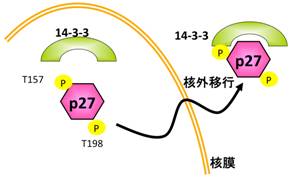
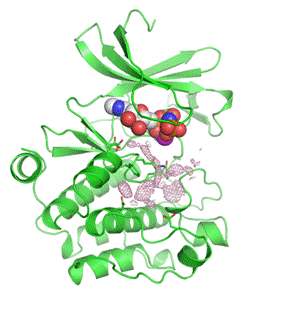 PimはサイトカインレセプターやBcr-Ablの下流に位置し、これら刺激依存的に迅速な転写誘導が起き、すぐにユビキチン-プロテアソーム系により分解される。PimはAkt同様に生存増殖シグナルを伝達することから、がん化におけるPimキナーゼの重要性に注目が集まっている。現在までに3種類のアイソフォーム(Pim-1、-2、-3)が同定されているが、これらはいずれもセリン・スレオニンキナーゼをコードしている。Pim-1とPim-2がリンパ腫や前立腺がんで高発現していること、Pim-3が膵がんや肝がんで高発現していることなどが報告されている。AktはK/R-X-R-X-X-S/T、PimはK/R-K/R-R-K/R-X-S/T(Xは任意のアミノ酸、他はアミノ酸の一文字表記)といったアミノ酸配列をもつ基質をリン酸化し、アポトーシスシグナル伝達系の阻害・増殖シグナル伝達系の活性化・細胞周期進行・代謝促進に関わり、全体として細胞生存・細胞増殖を誘導する。これまでのPimの細胞周期制御因子に対する影響の検討から、PimはCDK(cyclin-dependent kinase)阻害分子p27Kip1の157あるいは198番目のスレオニン残基(T157あるいはT198)を直接リン酸化し、p27Kip1の14-3-3タンパク質との結合誘導・核外移行を促進し、その結果としてp27Kip1のCDK阻害活性を喪失させることを見いだしている(Cancer Res., 2008)。また、Pimはp27Kip1の転写制御に関わるFOXO転写因子をもリン酸化し、その機能を阻害することでp27Kip1の転写を抑制することも見いだしている。理研の横山茂之先生らとの共同研究により、Pimとp27Kip1ペプチドの共結晶を作ることに既に成功しており(JBC, 2011)、この三次元構造解析結果に基づく新たな薬剤の開発にも取り組んでいる。
PimはサイトカインレセプターやBcr-Ablの下流に位置し、これら刺激依存的に迅速な転写誘導が起き、すぐにユビキチン-プロテアソーム系により分解される。PimはAkt同様に生存増殖シグナルを伝達することから、がん化におけるPimキナーゼの重要性に注目が集まっている。現在までに3種類のアイソフォーム(Pim-1、-2、-3)が同定されているが、これらはいずれもセリン・スレオニンキナーゼをコードしている。Pim-1とPim-2がリンパ腫や前立腺がんで高発現していること、Pim-3が膵がんや肝がんで高発現していることなどが報告されている。AktはK/R-X-R-X-X-S/T、PimはK/R-K/R-R-K/R-X-S/T(Xは任意のアミノ酸、他はアミノ酸の一文字表記)といったアミノ酸配列をもつ基質をリン酸化し、アポトーシスシグナル伝達系の阻害・増殖シグナル伝達系の活性化・細胞周期進行・代謝促進に関わり、全体として細胞生存・細胞増殖を誘導する。これまでのPimの細胞周期制御因子に対する影響の検討から、PimはCDK(cyclin-dependent kinase)阻害分子p27Kip1の157あるいは198番目のスレオニン残基(T157あるいはT198)を直接リン酸化し、p27Kip1の14-3-3タンパク質との結合誘導・核外移行を促進し、その結果としてp27Kip1のCDK阻害活性を喪失させることを見いだしている(Cancer Res., 2008)。また、Pimはp27Kip1の転写制御に関わるFOXO転写因子をもリン酸化し、その機能を阻害することでp27Kip1の転写を抑制することも見いだしている。理研の横山茂之先生らとの共同研究により、Pimとp27Kip1ペプチドの共結晶を作ることに既に成功しており(JBC, 2011)、この三次元構造解析結果に基づく新たな薬剤の開発にも取り組んでいる。
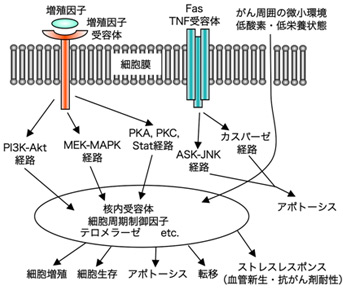
このように、PI3K-Akt経路そしてPim経路のさらなる解析を行なうことにより、抗がん剤の標的となる分子・その活性制御機構を明らかにし、新たな抗がん剤のシードとなる化合物の同定につなげていきたいと考えている。 また、近年では、肺がんや大腸がんを中心にドライバーがん遺伝子産物からの細胞内シグナル伝達にも着目した研究を進めており、例えば、ALK融合遺伝子陽性肺がん細胞やEGFR活性化変異を持つ肺がん細胞、BRAF活性化変異陽性の大腸がん細胞株を用いて、分子標的薬により細胞内シグナルがどのように変化し、がんが耐性を獲得するまでにどのような変化が生じていくのかを、リン酸化プロテオーム解析や、1細胞レベルのRNAシーケンス解析を通じて研究し、新たな治療標的となる分子やパスウェイの探索を行っている。
Recent publications:
- Akt kinase-interacting protein1, a novel therapeutic target for lung cancer with EGFR activating and gatekeeper mutations. Yamada T, Takeuchi S, Fujita N, Nakamura A, Wang W, Li Q, Oda M, Mitsudomi T, Yatabe Y, Sekido Y, Yoshida J, Higashiyama M, Noguchi M, Uehara H, Nishioka Y, Sone S, *Yano S. Oncogene, 2013 Sep 12; 32(37): 4427-35.
- Cell-permeable carboxy-terminal p27Kip1 peptide exhibits anti-tumor activity by inhibiting Pim-1 kinase.
Morishita D, Takami M, Yoshikawa S, Katayama R, Sato S, Kukimoto-Niino M, Umehara T, Shirouzu M, Sekimizu K, Yokoyama S, *Fujita N.
J Biol Chem. 2011 Jan 28;286(4):2681-8 - Centrosomal Aki1 and cohesin function in separase-regulated centriole disengagement.
Nakamura A, Arai H, *Fujita N.
J Cell Biol. 2009 Nov 30;187(5):607-14 - Pim kinases promote cell cycle progression by phosphorylating and down-regulating p27Kip1 at the transcriptional and posttranscriptional levels.
Morishita D, Katayama R, Sekimizu K, Tsuruo T, *Fujita N.
Cancer Res. 2008 Jul 1;68(13):5076-85. - Freud-1/Aki1, a novel PDK1-interacting protein, functions as a scaffold to activate the PDK1/Akt pathway in epidermal growth factor signaling.
Nakamura A, Naito M, Tsuruo T, *Fujita N.
Mol Cell Biol. 2008 Oct;28(19):5996-6009. - FOXO transcription factor-dependent p15(INK4b) and p19(INK4d) expression.
Katayama K, Nakamura A, Sugimoto Y, Tsuruo T, *Fujita N.
Oncogene. 2008 Mar 13;27(12):1677-86.