研究内容
- ヒトがん細胞パネル(JFCR39)を用いた薬剤感受性―マルチオミックス統合データベース(JFCR39-DB)の開発と抗がん剤スクリーニング
- 新規PI3K阻害剤ZSTK474の同定と創薬研究
- ゴルジ体を標的とした新規抗がん物質の同定と抗がん分子機序の解析
2. 新規PI3K阻害剤ZSTK474の同定と創薬研究
PI3キナーゼ(PI3K)は、細胞膜の脂質二重層に存在するリン脂質、ホスファチジルイノシトール(PI)をリン酸化する酵素である。細胞外からの増殖因子シグナルによって活性化される受容体チロシンキナーゼにより活性化され、PI二リン酸(PIP2)からPI三リン酸(PIP3)を生成することにより細胞内シグナル伝達を活性化する。種々のアイソフォームが知られているが、細胞増殖シグナルにはPIK3CA遺伝子がコードするクラス1A PI3Kのαアイソフォーム(p110α)が重要であると考えられている。一方、PIP3を脱リン酸化してPIP2に戻す酵素であるPTEN(Phosphatase and Tensin Homolog deleted from chromosome 10)が知られている。がんにおいては、PIK3CA遺伝子の機能獲得型変異や、PTEN遺伝子の欠損など、結果的にPIP3を過剰に産生するような遺伝子異常が高頻度に起きており、それが発がんやがん細胞の増殖促進の要因となる。このことから、PI3Kはがん治療の有用な分子標的と考えられていた。
分子薬理部では、JFCR39パネルを用いて全薬工業が開発した新規抗がん物質ZSTK474の作用メカニズム解析を行い、本剤が既存のPI3K阻害剤であるLY294002のフィンガープリントと類似することから、その抗がん分子機構はPI3キナーゼ阻害であると予測した。そこで、実験的にZSTK474がPI3K活性を抑制すること、細胞レベルでAkt以下のPI3K下流シグナルを抑制すること、動物レベルでヒトがんゼノグラフトに顕著な抗がん活性を示し、毒性は軽微であることを明らかにした(図)(1)。
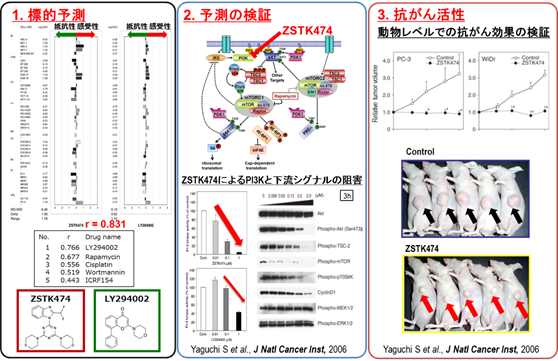
その後、本化合物の創薬研究は、(独)医薬基盤研究所 保健医療分野における基礎研究推進事業に採択された。当部ではZSTK474の特徴を克明に調べ、全薬工業では、臨床試験に進めるために必要な剤型開発、薬物動態研究、GLP試験などを完了し、FDA(アメリカ食品医薬品局)の審査を経て、2011年より米国で、翌年2012年より日本で臨床試験がされた(詳しくは、注目すべき臨床試験と論文を参照)。
当部の非臨床研究成果により、ZSTK474の分子作用機序(G1アレスト)、標的特異性、さまざまながんモデルでの有効性、血管新生阻害作用などを明らかにしてきた(表)。また、JFCR39システムを活用して効果予測バイオマーカーの探索を試み、感受性バイオマーカーとしてリン酸化Aktの高発現、抵抗性バイオマーカーとしてKRAS/BRAF遺伝子の機能獲得変異を見出した(7)。また、長期投与後の獲得耐性研究も進めており(8,9)、臨床応用を見据えた幅広い基礎研究を展開している。

関連リンク
- (独)医薬基盤研究所 保健医療分野における基礎研究推進事業「PI3キナーゼ(ホスファチジルイノシトール3キナーゼ)を標的とする分子標的薬の創製」
 (4.5MB)
(4.5MB) - 注目すべき臨床試験と論文「がん化学療法センター分子薬理部が新しい分子標的薬の開発に貢献!」
参考文献
- Yaguchi S, Fukui Y, Koshimizu I, Yoshimi H, Matsuno T, Gouda H, Hirono S, Yamazaki K, Yamori T. Antitumor activity of ZSTK474, a new phosphatidylinositol 3-kinase inhibitor. J Natl Cancer Inst. 2006 Apr 19;98(8):545-56.
- Lockhart AC, Olszanski AJ, Allgren RL, Yaguchi S, Cohen SJ, Hilton JF, et al. A first-in-human phase I study of ZSTK474, an oral pan-PI3K inhibitor, in patients with advanced solid malignancies [abstract]. In: Proceedings of the AACR-NCI-EORTC International Conference: Molecular Targets and Cancer Therapeutics; 2013 Oct 19–23; Boston, MA. Philadelphia (PA): AACR. Abstract nr B271. Mol Cancer Ther 2013;12:B271.
- Kong D, Dan S, Yamazaki K, Yamori T. Inhibition profiles of phosphatidylinositol 3-kinase inhibitors against PI3K superfamily and human cancer cell line panel JFCR39. Eur J Cancer. 2010 Apr;46(6):1111-21.
- Kong D, Yamori T, Yamazaki K, Dan S. In vitro multifaceted activities of a specific group of novel phosphatidylinositol 3-kinase inhibitors on hotspot mutant PIK3CA. Invest New Drugs. 2014 Dec;32(6):1134-43.
- Dan S, Okamura M, Mukai Y, Yoshimi H, Inoue Y, Hanyu A, Sakaue-Sawano A, Imamura T, Miyawaki A, Yamori T. ZSTK474, a specific phosphatidylinositol 3-kinase inhibitor, induces G1 arrest of the cell cycle in vivo. Eur J Cancer. 2012 Apr;48(6):936-43.
- Kong D, Okamura M, Yoshimi H, Yamori T. Antiangiogenic effect of ZSTK474, a novel phosphatidylinositol 3-kinase inhibitor. Eur J Cancer. 2009 Mar;45(5):857-65.
- Dan S, Okamura M, Seki M, Yamazaki K, Sugita H, Okui M, Mukai Y, Nishimura H, Asaka R, Nomura K, Ishikawa Y, Yamori T. Correlating phosphatidylinositol 3-kinase inhibitor efficacy with signaling pathway status: in silico and biological evaluations. Cancer Res. 2010 Jun 15;70(12):4982-94.
- Isoyama S, Dan S, Nishimura Y, Nakamura N, Kajiwara G, Seki M, Irimura T, Yamori T. Establishment of phosphatidylinositol 3-kinase inhibitor-resistant cancer cell lines and therapeutic strategies for overcoming the resistance. Cancer Sci. 2012 Nov;103(11):1955-60.
- Isoyama S, Kajiwara G, Tamaki N, Okamura M, Yoshimi H, Nakamura N, Kawamura K, Nishimura Y, Namatame N, Yamori T, Dan S. Basal expression of insulin-like growth factor 1 receptor determines intrinsic resistance of cancer cells to a phosphatidylinositol 3-kinase inhibitor ZSTK474. Cancer Sci. 2015 Feb;106(2):171-8.