【プレスリリース】 ALK陽性肺がんに対する治療薬耐性の原因を発見 〜より効果的な治療法の選択へ道〜
2015年12月25日
1.概要
ALK融合遺伝子を持つ肺がん(ALK陽性肺がん)は非小細胞肺がんの患者さん100人の内3〜5人程度に見つかるといわれています(日本人で推定2000症例/年)。ALK融合遺伝子(注1)とは、受容体型チロシンキナーゼ(注2)をコードするALK遺伝子と他の遺伝子が融合してできた異常ながん遺伝子であり、ALK融合遺伝子からできたALK融合タンパク質では、恒常的なALKチロシンキナーゼの活性化により細胞増殖シグナルが出続け、がん細胞が増殖します。このALK陽性肺がんに対しては、異常活性化したALKのチロシンキナーゼ活性を阻害できるALKチロシンキナーゼ阻害薬(ALK阻害薬)が有効であることが明らかとなっており、現在では複数のALK阻害薬が臨床応用されています。しかし一方で、多くの症例で数年以内に薬剤耐性を持ったがん細胞が出現し、再発してしまうことが問題となっていました。
片山量平 主任研究員(がん研究会 がん化学療法センター 基礎研究部)と 藤田直也 所長(がん研究会 がん化学療法センター)、西尾誠人 部長(がん研究会 有明病院 呼吸器内科)及びマサチューセッツ総合病院(MGH)がんセンターの研究グループは、ALK陽性肺がんに対する次世代ALK阻害薬Ceritinib(米国・欧州で承認されており、本邦では承認申請中)に対する耐性を引き起こす原因として、新たに薬剤排出トランスポーターの1つであるP糖たんぱく質(ABCB1)(注3)の過剰発現がCeritinibのがん細胞外への排出を促進し、Ceritinib耐性を起こしていること発見しました。そして、その耐性に対してP糖たんぱく質の阻害剤とCeritinibの併用療法や、P糖たんぱく質による排出の影響を受けないALK阻害薬(アレクチニブやLorlatinib)が有効であることを示す結果を得ました。本研究の成果は、Cell誌とLancet誌が共同でサポートする新規オープンアクセス誌EBioMedicineに、2015年12月18日付で公開されました。
2.ポイント
- ALK陽性肺がんに対する次世代ALK阻害薬Ceritinib(国内承認申請中,米・欧承認済)への耐性機構として、新たにP糖たんぱく質(ABCB1)の過剰発現がCeritinibの細胞外排出を亢進して耐性を起こすことを発見しました
- P糖たんぱく質の過剰発現は11例中3例のALK阻害薬耐性となった腫瘍において確認され、さらに第1世代ALK阻害薬クリゾチニブ抵抗性にも関与することを発見しました。
- P糖たんぱく質を介したCeritinib耐性には、P糖たんぱく質阻害剤とCeritinibの併用療法または、P糖たんぱく質による排出の影響を受けにくいALK阻害薬アレクチニブ(本邦で2014年に承認)などが有効であることが示されました。
- 本研究から、今後様々なALK阻害薬がALK陽性肺がんに対して使用可能となった場合、P糖たんぱく質の発現を免疫染色法などにて検索することが、より効果的な治療法の選択に役立つことが期待されます。
3.論文名、著者およびその所属
・論文名
・ジャーナル名
EBioMedicine (Cell誌とLancet誌が共同でサポートする新規オープンアクセス誌)
(※12月18日付でオンラインに掲載されています。)
・著者
Ryohei Katayama1*, Takuya Sakashita1,2, Noriko Yanagitani3, Hironori Ninomiya4, Atsushi Horiike3, Luc Friboulet5, Justin F. Gainor5, Noriko Motoi4, Akito Dobashi4, Seiji Sakata4, Yuichi Tambo3, Satoru Kitazono3, Shigeo Sato1, Sumie Koike1, A. John Iafrate6, Mari Mino-Kenudson6, Yuichi Ishikawa4, Alice T. Shaw5, Jeffrey A. Engelman5, Kengo Takeuchi4, Makoto Nishio3*, Naoya Fujita1*
* 責任著者
・著者の所属機関
1. (公財)がん研究会 がん化学療法センター 基礎研究部
2. 東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻
3. (公財)がん研究会 有明病院 呼吸器内科
4. (公財)がん研究会 がん研究所 病理部/分子標的病理プロジェクト
5. マサチューセッツ総合病院 がんセンター
6. マサチューセッツ総合病院 病理部
4.研究の背景と内容
がんは我が国の主たる死亡原因の疾患であり,生涯の間に国民の2人に1人が,がんに罹患するとされています。なかでも肺がんはがんによる死亡原因のトップであり、より効果的な治療法の開発が切望されています。遠隔転移や浸潤などのある進行肺がんでは,外科手術による治療が困難な場合が多く,薬物療法や放射線療法が中心となっています。薬物療法としては近年までは殺細胞性の抗がん剤による化学療法が中心でしたが、この約10年の間にEGFRチロシンキナーゼ阻害薬(ゲフィチニブやエルロチニブなど)の登場と,EGFR活性化型変異の発見を契機に,肺がんの領域においても分子標的薬の有用性が高まってきております。さらに2007年には,間野博士(東京大学)らのグループにより肺がんにおける強力ながん遺伝子としてALK融合遺伝子が発見され,非小細胞肺がん(肺がん全体の約8割を占める)の3~5%の症例(日本人で推定2000症例/年)がALK陽性肺がんであることが明らかになってきています。このALK陽性肺がんに対して行われた第1世代のALK阻害薬クリゾチニブの臨床試験の結果では高い奏功が認められており,2012年には本邦においても承認され実臨床で使用されています。しかしながらクリゾチニブによる治療を始めてから1年〜数年程度するとほとんどのケースにおいて治療抵抗性を獲得した耐性腫瘍が出現することが大きな問題となっています。この耐性がどのようなメカニズムで生じるのかを明らかにし,耐性を克服できる特異的治療法の発見が,より効果的な薬物療法の発展にとって重要であると考えられ,現在盛んに研究が進められており、これまでに片山らを含む世界中の様々なグループからクリゾチニブへの耐性のメカニズムが報告されています。最も高頻度に見られるクリゾチニブ耐性機構としては,ALKのチロシンキナーゼ領域のATP結合ポケットに存在する1196番目のロイシン(L)がメチオニン(M)に代わるゲートキーパー変異と呼ばれる耐性変異があり、他にも様々なタイプのALKキナーゼ領域の変異が報告されています。これらのクリゾチニブ耐性変異型ALKにも有効な薬剤として、様々な第2世代ALK阻害薬が開発されており、中でもアレクチニブとCeritinibは臨床試験の結果、顕著な腫瘍縮小効果が認められており、アレクチニブは2014年7月に本邦で世界に先駆けて承認され、米国においても2015年12月に承認されています。一方Ceritinibは2014年3月に米国、2015年5月に欧州にて承認されており、本邦においては2015年6月に承認申請がなされていています。アレクチニブ、CeritinibいずれもL1196Mゲートキーパー変異や他のクリゾチニブ耐性変異(G1269Aなど)にも有効であることが示されており期待されている薬剤ですが、アレクチニブやCeritinibに対しても数年以内に耐性が生じ再発してしまうことが明らかになってきつつあります。これまでに我々と米国MGHのグループで共同研究を行い、第2世代ALK阻害薬アレクチニブやCeritinibに対する新規耐性変異を同定し報告してきました (Friboulet L and Katayama R et al., Cancer Discov. 2014,Katayama R et al., Clin Cancer Res 2014)。Ceritinibに対する耐性機構としては、10例中4例からALKキナーゼ領域内の耐性変異を発見しており、中でもG1202R変異はクリゾチニブ、アレクチニブ、Ceritinibいずれにも耐性を示してしまう変異であり、現在その耐性をも克服できる薬剤の開発が世界で行われており、現在臨床試験が行われているLorlatinibが期待されています。一方、Ceritinib耐性の10例中6例ではALKに遺伝子変異はなく、これまで耐性機構は不明なままでした。
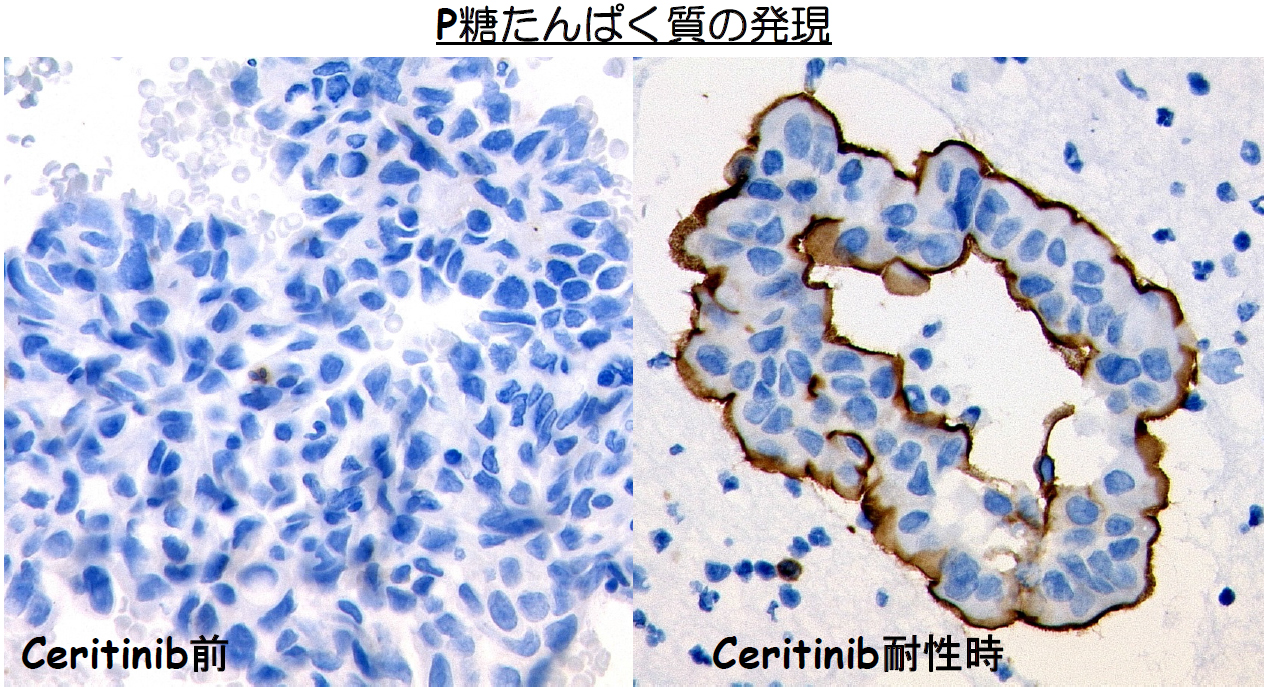
本研究では、その他のCeritinib耐性機構を明らかにするために、Ceritinib治療後に耐性となった症例を詳細に解析した結果、がん関連遺伝子の変異や増幅などの遺伝子異常は見つかりませんでしたが、新たにP糖たんぱく質が過剰発現することで腫瘍細胞からCeritinibが細胞外へと排出されることで耐性となっていることを発見しました (図A)。
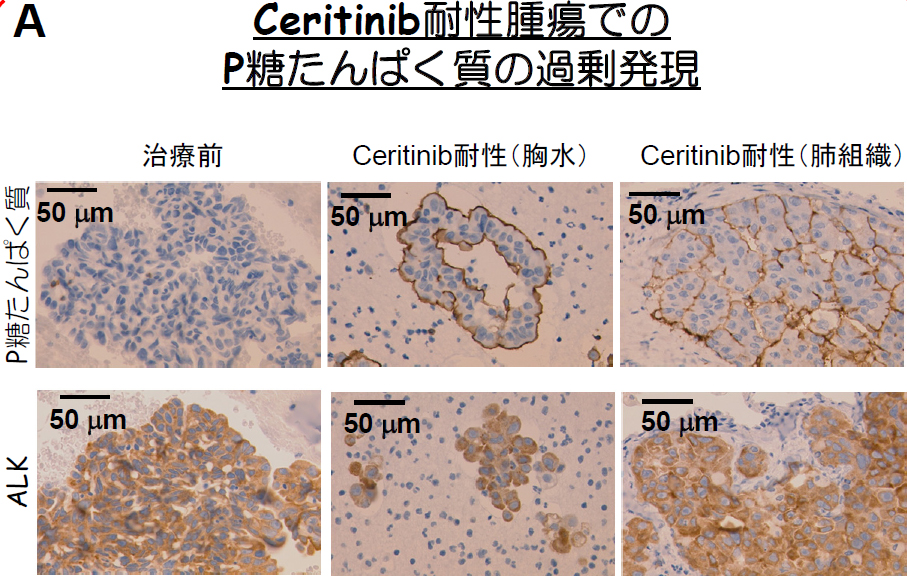
このP糖たんぱく質(ABCB1)は細胞膜上に存在するABCトランスポーターファミリーの1つであり、ATPを駆動力として毒素をはじめとして様々な化合物を細胞外へ排出します。P糖たんぱく質は小腸、血液脳関門、肝臓、腎臓に高く発現しており、異物から体(組織)を守る大事な役割を果たしています。がんにおいては、P糖たんぱく質が過剰発現することで、ドセタキセルをはじめとして様々な化学療法剤に耐性を獲得するようになることが明らかとされてきました。これまでに化学療法剤への多剤耐性機構の1つとしてのP糖たんぱく質の過剰発現については多くの研究がなされてきましたが、近年の分子標的薬に対する耐性機構としても実際に重要な役割を果たすのかどうかは明らかでありませんでした。本研究において我々は、ALK陽性肺がんのCeritinib耐性症例からP糖たんぱく質の過剰発現を発見し、それがCeritinib耐性の原因のであることを明らかにし、さらにクリゾチニブに対する耐性にも関与することを明らかにしました。
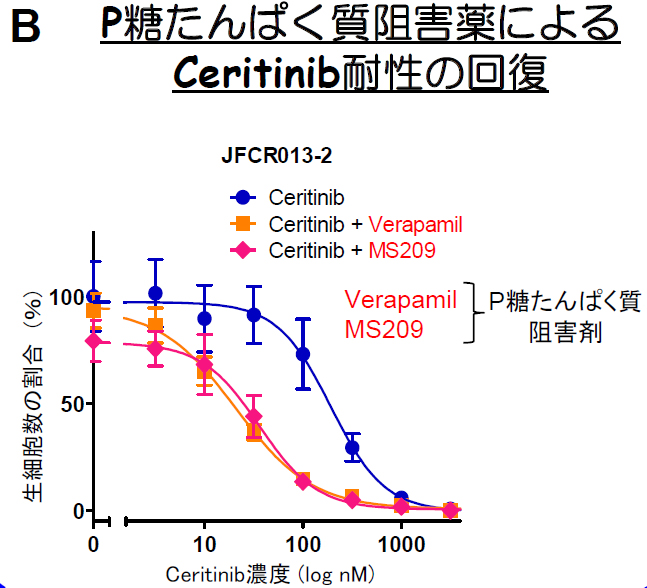
このP糖たんぱく質の過剰発現によるCeritinib耐性を克服するために、かつて化学療法剤耐性を克服するために開発が進められてきたP糖たんぱく質の阻害剤(MS209)を用いてCeritinibとの併用療法を試みた結果、MS209の併用でP糖たんぱく質によるCeritinibやクリゾチニブ耐性が克服されました(図B)。
さらに、他のALK阻害薬についても検討したところ、アレクチニブや現在世界で臨床試験が進められているLorlatinibは、P糖たんぱく質過剰発現による薬剤感受性の変化はなく、P糖たんぱく質が過剰発現したCeritinib耐性患者由来の細胞株にも低濃度で増殖抑制効果を示しました。次にP糖たんぱく質を介した耐性が他の症例でも見られるかどうかを明らかにするためにさらに10例のALK阻害薬耐性症例を用いてP糖たんぱく質の発現を免疫染色法にて検討した結果、さらに2例においてP糖たんぱく質の過剰発現を発見し、うち1例では生検検体より樹立した細胞株においてもP糖たんぱく質が過剰発現しCeritinib耐性に大きく寄与していることが確認できました。これまでの研究と本研究から、ALK陽性肺がんでは様々なメカニズムによりALK阻害薬耐性が起こっていることが徐々に明らかとなってきました。(下図)
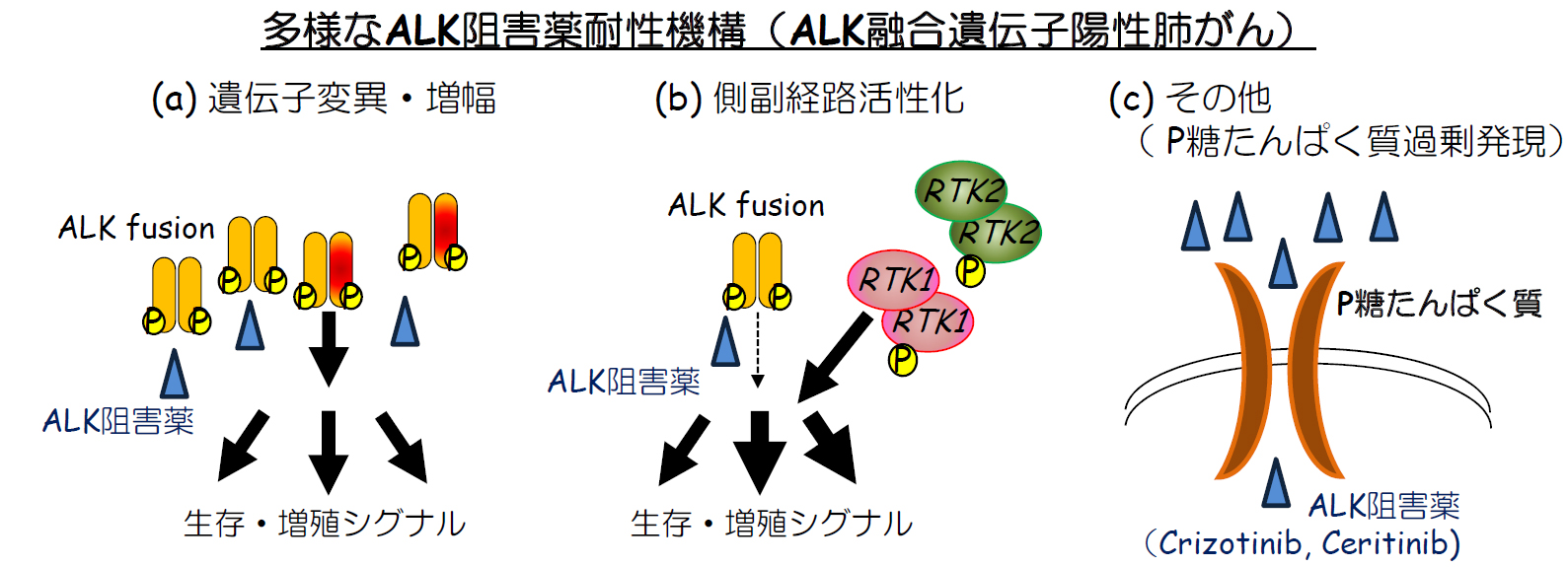
現在本邦では、ALK阻害薬としてはクリゾチニブ、アレクチニブが承認され臨床応用されています。米国では、クリゾチニブ、Ceritinib、そしてアレクチニブがFDAにより承認されています。本研究の結果から、今後様々なALK阻害薬が使用可能となった場合、ALK阻害薬耐性となった時に、ALK遺伝子の変異に加えて、P糖たんぱく質の発現を免疫染色法等にて検索することで、より効果的な治療法の選択に(ALK阻害薬のみならず、化学療法剤の選択にも)役立つことが予想されます。本研究の結果では耐性機構が明らかにできなかった症例がまだ複数存在することから、今後さらに,ALK阻害薬耐性機構を解明することも重要な課題です。また、他の分子標的薬も含めて、P糖たんぱく質などの薬剤排出トランスポーターの耐性への関与も明らかにしていくことも重要です。
5.本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
・AMED 革新的がん医療実用化研究事業
・日本学術振興会 科学研究費補助金
6.用語解説
(注1)ALK融合遺伝子
ALK遺伝子と他の遺伝子(EML4遺伝子など)が融合してEML4-ALKなどのALK融合遺伝子が生じます。ALK融合遺伝子産物のALK融合たんぱく質は、ALK受容体型チロシンキナーゼの細胞内領域と2量体・他量体形成能を有するたんぱく質が融合し、ALKチロシンキナーゼが恒常的に異常活性化します。それにより細胞増殖シグナルが常時活性化をし、がん化が引き起こされます。ALK融合遺伝子陽性の肺がん細胞はALKのチロシンキナーゼ活性に依存して生存・増殖しているため、ALKチロシンキナーゼ阻害薬によりがん細胞の生存・増殖は抑制されます。
(注2) チロシンキナーゼ
キナーゼとは基質をリン酸化する酵素の総称であり、そのうちチロシンキナーゼは基質たんぱくのチロシン残基をリン酸化する酵素のことです。一般にその活性化は私たちの細胞の増殖を正に誘導します。
(注3) P糖たんぱく質
P糖たんぱく質(ABCB1)は細胞膜上に存在するABCトランスポーターファミリーの1つです。ABC (ATP Binding Cassette)トランスポーターとはATP(アデノシン3リン酸)結合領域を有し、ATPを駆動力として細胞内から細胞外へと基質を排出します。P糖たんぱく質は毒素をはじめとして様々な幅広い基質(主として疎水性のカチオン)を細胞外へ排出します。P糖たんぱく質は小腸、血液脳関門、肝臓、腎臓に高く発現しており、薬物や異物を管腔側へと排出し、体(組織)を守る大事な役割を果たしています。がんにおいては、P糖たんぱく質が過剰発現することで、ドセタキセルをはじめとして様々な化学療法剤に耐性を獲得するようになることが明らかとされてきました。
関連PDF
- 《プレスリリース文書》 ALK陽性肺がんに対する治療薬耐性の原因を発見
 (794.9KB )
(794.9KB )