
�㕔�����Ǔ���
�f�ÉȂ̓����b�f�Î����b�X�^�b�t�Љ��b�g�s�b�N�X
�������f�f�Ǝ���
�����������Ƃ́A1cm���x�̑����̓���̃X�R�[�v��p����(�ʐ^1)�A������(�H���A�݁A�\��w���A�����A�咰)�̓����Ɉُ킪�Ȃ����ǂ����ׂ錟���@�ł��B

�ȑO�̓������́A�������̂悤�ɔ`���Ȃ���ώ@����t�@�C�o�[�X�R�[�v�ł������A���݂͓d�q�X�R�[�v�̂��߁A���j�^�[��ʂɉ摜���ʂ��o����A�����ǂ̓��������A���^�C���Ɋm�F���邱�Ƃ��\�ł��B(�ʐ^2) �����������͋ꂵ���A�ɂ��Ȃǂ̃C���[�W�������Ă�����������A�܂��ߋ��Ɍo�������݂�咰�̓������������ƂĂ��ꂵ���āA2�x�Ǝ����Ȃ��Ƃ���������������Ⴂ�܂��B
���@�ł́A���̂悤�ȕ��ɂł��邾����ɂȂ��������Ă����������߂ɁA������(���Í܁A���ɍ܂̐Ö�����)���g�p�����������s���Ă��܂��B���Í܂��g�p���邱�ƂŁA�قƂ�ǂ̕������C���Â��Ă��Ƃ��Ƃ��Ă��邤���Ɍ������I���邱�Ƃ��ł��܂��B
�����������ɂ�������Í܂̎g�p�́A�������̊Ǘ�����������ƍs�����ƂŁA���S�Ɏg�p���邱�Ƃ��ł��A�܂����҂���ɂƂ��Ă��������y�ɂȂ邾���łȂ��A���������s����t�ɂƂ��Ă��A��萸���Ȍ������s�����Ƃ��ł��܂��B���@�ł́A�������������ɒ��Í܂���]������ɂ́A���S�Ɏg�p�ł��邢�����̏������m�F������ŁA�g�p���Ă��܂��B
�����ǂ̊��̂����A���Ɉ݂���A�咰����͕p�x�������A�{�M��2013�N�x�̂��S�����v�ł́A�j���͈݂����2�ʁA�咰�����3�ʁA�����͑咰�����1�ʁA�݂����3�ʂƕ���Ă��܂��B
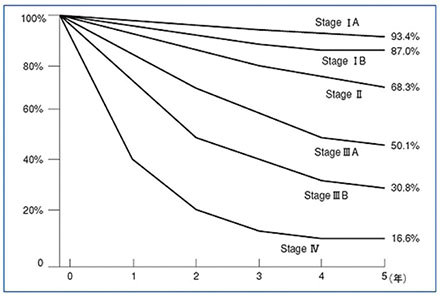
���̂悤�Ɏ��S���̑����݂���A�咰����ł����A����̐i�s�̒��x��\���X�e�[�W���ނɂ����āA����̑����i�K�ł���X�e�[�W�T�ł���A���Ì��5�N�ȏ㐶���ł��銄����90%�ȏ�ł��B(�}1)�@���̂��Ƃ���A�݂���A�咰����Ƃ����o�ǏȂ��i�K�Ŕ������A���Â��s�����Ƃ��ł��d�v�ł��B
�ŋ߂ł́A�����f�f���ꂽ����́A������炸�A�������̓������ōs���������I�S���؏��p(EMR)��������I�S�����w�����p(ESD)�ȂǁA�̂ɕ��S�����Ȃ����@�Ŏ��Â��ł��܂��B���̂悤�ȓ������Ŏ��Âł���i�K�ŕa�ς�f�f���邽�߂ɂ́A�������͕s���Ȍ����Ƃ��Ĉʒu�Â����Ă��܂��B
���@�ł́A�N�ԂɐH���E�݁E�咰�̓�����������2���l�ȏ�̕��ɍs���Ă���A�{�M�ł��g�b�v�N���X�̓������������A���Ð����s���Ă��܂��B
�܂������E���Ð������������łȂ��A���Õ��j�̌���ɂ́A��������A�O�Ȉ�A���w�Ö@��A���ː����È�A�a����ȂǕ����̐��オ�Q������J���t�@�����X�����I�ɍs��(�ʐ^3)�A�őP�Ǝv���鎡�Â����̐��𐮂��Ă��邱�Ƃ��A���{���\���邪����a�@�Ƃ��Ă̓��F�̂ЂƂł��B


