研究内容
出典:細胞工学2015年
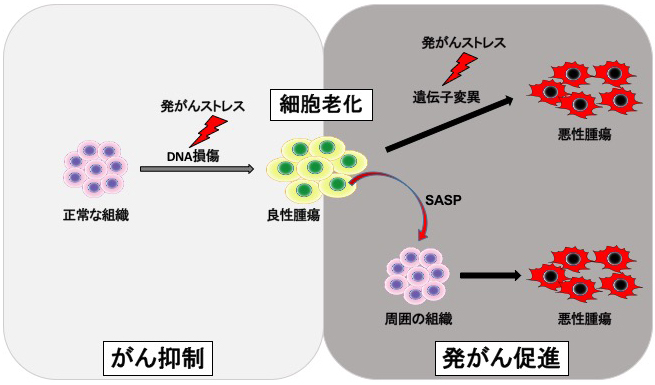
私たちの体を構成する細胞は加齢と伴に「細胞老化」をおこします。さまざまなストレスで細胞老化が誘導されると細胞の増殖は不可逆的に停止することが知られています(Takahashi et al., Nature Cell Biology, 2006: Imai et al., Cell Reports, 2014)。
がん遺伝子の活性化や酸化的ストレスなどの発がんストレスも細胞老化を引き起こす原因の一つであり、私たちは細胞老化が生体内でがん抑制機構として働くことを老化細胞イメージングマウスや発がんマウスモデルを用いて報告してきました(Yamakoshi & Takahashi et al., J Cell Biology, 2009)。
その一方で、加齢と伴に体内に蓄積した老化細胞はさまざまな炎症性蛋白質を高発現し周囲に分泌するSASP (Senescence-associated secretory phenotype)をおこして、がんをはじめとするあらゆる加齢性疾患の発症原因となることが明らかになってきました。 私たちは細胞老化でSASPがおこる分子メカニズムの解析を行い、老化細胞ではDNAメチル化酵素(DNMT1)やヒストンメチル化酵素(G9a/GLP)の発現低下によってエピジェネティックな遺伝子発現抑制機構が破綻し、様々なSASP遺伝子の発現が誘導されることを世界に先駆けて明らかにしてきました(Takahashi et al., Molecular Cell, 2012)。さらに老化した細胞では、エピゲノムの異常がおこり正常な細胞では転写されていないペリセントロメア領域からnon-coding RNAが発現しており、染色体構造を変化させることでSASP遺伝子群の発現を誘導することを報告しました(Miyata et al., PNAS, 2021; Miyata et al., Nucleus, 2022)。
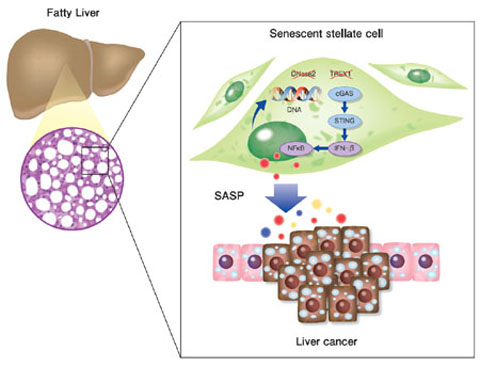
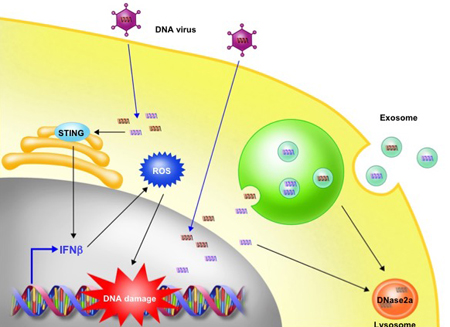
また、私たちは肥満誘導性の肝がんの発症には、細胞老化によるDNA分解酵素の発現低下とDNAセンサー経路の活性化によるSASP誘導機構が重要であることを報告しました。正常な細胞では、細胞質に存在するDNA断片は、DNA分解酵素によって速やかに除去される生体防御機構が働きますが、老化した細胞ではDNase2やTREX1といったDNA分解酵素の発現レベルが下がるために細胞質にゲノムDNA断片が蓄積し、DNAセンサー経路(cGAS-STING)の活性化を介して自然免疫応答がおこることで、SASPを誘導する新たなメカニズムが存在することを明らかにしました(Takahashi et al., Nature Communications, 2018; Loo et al., Cancer Science, 2020)。
作図 Studio M Two
老化細胞では炎症性タンパク質だけでなくエクソソームの分泌も亢進しており(Takahashi et al., Nature Communications, 2017; Hitomi et al., Int. J. Mol. Sci., 2020)、SASP因子の一つとしてがんの進展に働くことを見出しています(Miyata et al., PNAS, 2021)。
最近では、加齢や肥満などにより体内に老化細胞が蓄積すると、SASP因子を介してがんの発生の初期に重要ながん抑制機構である細胞競合を阻害することで、がん変異細胞の生存や増殖や浸潤を促すことを明らかにしました(Igarashi et al., Nature Communications, 2022)。がんの微小環境には老化した間質細胞やがん細胞が存在することから、それらを標的とした新しいがんの治療法の開発を目指しています。
このように私たちは、個体の老化現象の基礎機構として働く細胞老化を研究することで、「老化」という生命現象の解明を目指しています。
私たちが取り組んでいる研究プロジェクト
- 細胞老化でSASPがおこるメカニズムの解明
- 細胞老化特異的なエピゲノム変化とnon-coding RNAの解析
- 老化細胞が分泌するエクソソームの機能解析
- がん微小環境の老化細胞とがん細胞の制御を目指した新規治療法の開発
- マウスモデルを用いた老化という生命現象の解明