【プレスリリース】新しいモデルマウスを用いてユーイング肉腫の発生母地を同定することに成功
2014年06月03日
公益財団法人がん研究会
ポイント
l 小児〜若年者の骨のがんで、従来信頼出来る動物モデルが存在しなかったユーイング肉腫のモデルマウスを樹立することに成功しました。
l ユーイング肉腫の発生母地は永年不明でしたが、胎児の軟骨前駆細胞に集積していることを発見しました。
l 今回のモデルマウスは、ヒトのユーイング肉腫の病態や病理形態を良く反映していることから、ユーイング肉腫の治療薬の評価に広く応用されることが期待されます。
田中美和 研究員(がん研究会がん研究所 発がん研究部)と 中村卓郎 部長(がん研究会 がん研究所 発がん研究部)、及び国立医薬品食品研究所の研究グループは、従来作製が困難であったユーイング肉腫のモデルマウス確立に成功しました。
ユーイング肉腫は小児及び十代の若者の骨に発生するがんで、転移の頻度が高く有効な治療薬がないなど、悪性度の高いことが知られています。染色体転座により形成される融合遺伝子EWS-FLI11)がユーイング肉腫の原因遺伝子として同定される一方で、多くのがんとは異なり、ユーイング肉腫の発生起源についてはこれまで良く分かっていませんでした。また、信頼性の高い動物モデルも確立されていません。
本研究グループは、マウス胎児の関節から採取しeSZ細胞2)と名付けた軟骨前駆細胞にEWS-FLI1遺伝子を導入した実験により、ヒトのユーイング肉腫に極めて類似した肉腫が確実に形成されることを見出しました。この際に、EWS-FLI1に対する遺伝子発現応答が細胞によって異なることが肉腫形成に大きな影響を及ぼしていることが分かりました。マウスのユーイング肉腫で認められた遺伝子発現の変化はヒトでも同様に生じており、肉腫の増殖の鍵となる遺伝子発現を抑えると、肉腫の細胞死や増殖抑制が生じることが分かりました。今後、このモデルを利用することで、新しい分子標的治療薬の評価やユーイング肉腫の発生・進展及び転移のメカニズムが明らかになることが期待されます。
本研究の成果は、米国の医学雑誌『Journal of Clinical Investigation』オンライン版(米国時間6月2日付:日本時間6月3日)に掲載されます。
研究の背景
肉腫は骨や筋肉などの組織から発生するがんで、患者数が少ない稀少がんの代表格です。その一方で、若い患者にしばしば発生すること、悪性度が高く難治性の症例が少なくないこと、早期発見が難しいことなど多くの問題を含んでいます。ユーイング肉腫も小児や若年者に多く、発見が遅れると全身に転移することから、発生のメカニズムの解明と有効な治療法の開発が待たれています。ところが、その発生起源が未知であり、動物モデルを用いた実験が確立していないという問題がありました。本研究グループはユーイング肉腫のモデルマウス確立を通して、ユーイング肉腫の発生起源を明らかにし、治療法の開発に役立てたいと考えました。
研究の内容
1)ユーイング肉腫モデルマウスの作製
これまでの研究により、ユーイング肉腫ではEWS-FLI1やEWS-ERGといったETS転写因子2)を構成成分とする融合遺伝子の形成が特徴的であり、肉腫の発生と深く結びついていることが明らかにされています。 しかし、EWS-FLI1をマウスやヒトの細胞に発現させてもユーイング肉腫を作ることは出来ないばかりか、多くの細胞は細胞死や細胞老化を示すことが分かっていました。本研究グループは、EWS-FLI1をユーイング肉腫の発生起源細胞に発現させない限り本来の腫瘍が生じないのではないかと考え、その細胞が何か探りました。その過程において、融合遺伝子の構成成分の一つERG遺伝子が、マウスの胎児期に関節の表層部で一過性に発現する事実に注目しました。そこで、この細胞をeSZ細胞と名付け、マウス胎児から取り出したeSZ細胞にEWS-FLI1またはEWS-ERGを導入し、ヌードマウスの皮下に移植しました。その結果、融合遺伝子を発現するeSZ細胞を移植されたマウスは100%肉腫を発症し、この肉腫の組織を観察するとヒトユーイング肉腫に非常に良く類似していることが分かりました。一方、eSZ細胞に隣接する間葉系幹細胞や軟骨への分化が進んだ細胞ではEWS-FLI1を導入しても肉腫の発生頻度は低いことから、eSZ細胞はユーイング肉腫の起源細胞を濃密に含んでいることが分かりました(図1)。また、再現性の高い動物モデルが確立されたお陰で、ヒトでは観察することの出来ない、ユーイング肉腫の発生初期の状態をつぶさに観察することも可能となりました。
2)ユーイング肉腫の発生には細胞の特殊なエピゲノム状態が重要である
eSZ細胞にEWS-FLI1やEWS-ERGを発現させるとユーイング肉腫が形成されるのに、他の細胞では起きないのは何故でしょうか。転写因子として働くEWS-FLI1は、その標的遺伝子に存在する特異的な結合部位を認識して、その発現を変化させる機能を持っています。eSZ細胞では、標的遺伝子付近のクロマチンが、EWS-FLI1の結合し易い状態にあるという、特殊なエピゲノム環境を示していることが分かりました。これまでに同定されている標的遺伝子の多くは、今回のユーイング肉腫モデルにおいて発現が亢進しており、このことがeSZ細胞を使って肉腫を効率よく誘導出来る理由となったと考えられました。
3)ユーイング肉腫モデルマウスは新規治療法の評価系として有用である
現在ユーイング肉腫で最も有効な治療法は外科的切除であり、既存の抗がん剤は一定の効果を示すものの全身に転移を来した症例の治癒は困難とされています。したがって、ユーイング肉腫の増殖を特異的に阻害する副作用の少ない分子標的薬の開発が望まれています。特に、ユーイング肉腫細胞にしか存在しないEWS-FLI1を治療標的とする薬剤や、EWS-FLI1の標的遺伝子を狙った治療法が効果的な治療の有力候補とされます。今回作製したマウスのユーイング肉腫では、導入したEWS-FLI1遺伝子を取り除いてやると、肉腫細胞の増殖と生存能が著しく低下し、細胞が殆ど死滅することが分かりました。また、EWS-FLI1の標的遺伝子・シグナルであるEZH2やPARP1b-カテニンの阻害薬も一定以上の増殖抑制効果を示すことが明らかになりました。今回のモデルは、ヒトユーイング肉腫の予後を決定する重要な因子である転移も再現することが出来ているので、in vitroや局所に対する薬効評価だけではなく、転移能に対する治療効果の評価も可能となります。有望な分子標的薬や新規の抗がん剤を臨床試験の前段階で正しく評価するのに最適なモデルと考えています。今回の研究成果により、ユーイング肉腫の発生母地と発症機構の一端が明らかとなりました。本研究の成果を基に、今回のモデルを今後ヒトのユーイング肉腫に対する正確な治療効果の評価に利用することで、新たな治療薬の開発推進に貢献できることが考えらえます。また、ユーイング肉腫の他にも、同様に融合遺伝子を原因遺伝子とする滑膜肉腫や胞巣状軟部肉腫などの動物モデルを作製する道が開けたことから、骨軟部肉腫の本態解明が大きく前進するための一歩を築いたと考えています。本研究の成果を通して、稀少がんである難治性の肉腫の克服に貢献することが期待できます。
まとめ
今回の研究成果により、ユーイング肉腫の発生母地と発症機構の一端が明らかとなりました。本研究の成果を基に、今回のモデルを今後ヒトのユーイング肉腫に対する正確な治療効果の評価に利用することで、新たな治療薬の開発推進に貢献できることが考えらえます。また、ユーイング肉腫の他にも、同様に融合遺伝子を原因遺伝子とする滑膜肉腫や胞巣状軟部肉腫などの動物モデルを作製する道が開けたことから、骨軟部肉腫の本態解明が大きく前進するための一歩を築いたと考えています。本研究の成果を通して、稀少がんである難治性の肉腫の克服に貢献することが期待できます。
参考図
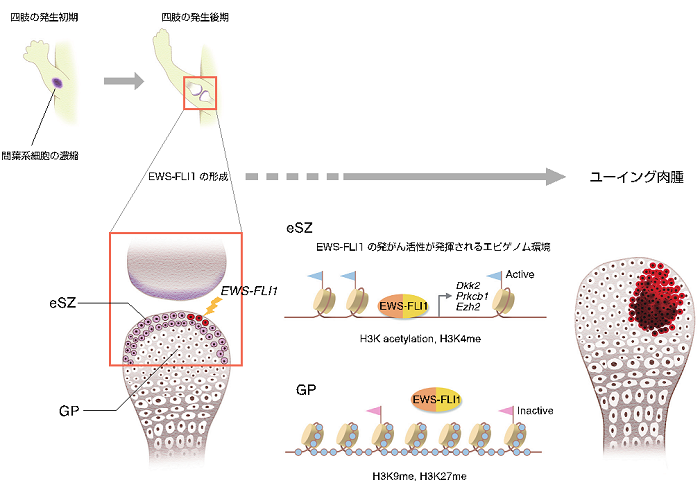
図1:ユーイング肉腫の発生機構。胎生期の関節表面に存在するeSZ細胞にEWS-FLI1が形成されることで、EWS-FLI1標的遺伝子が活性化されて肉腫が発生する。
用語解説
注1)融合遺伝子EWS-FLI1:
がんにおける重要な遺伝子異常の一つとして、染色体の転座や逆位によって二つの遺伝子が融合することがしばしば観察される。代表例として慢性骨髄性白血病におけるBCR-ABLや肺がんにおけるEML4-ALKなどが挙げられる。骨軟部肉腫では、融合遺伝子を有するものが全体の30〜40%存在すると言われている。ユーイング肉腫では22番染色体上のEWSR1遺伝子と、ETSファミリー転写因子群との間に融合が必発する。特に頻度が高いのは11番染色体上のFLI1遺伝子で、21番染色体上のERG遺伝子がこれに次ぐ。この結果、EWS-FLI1またはEWS-ERG遺伝子/蛋白が形成される。近年BCR-ABL等のシグナル系融合遺伝子には有効な阻害剤が続々と開発されているが、EWS-FLI1のような転写因子系融合遺伝子に有効な分子標的薬の開発は立ち遅れている。
注2)eSZ細胞:
胎生後期〜新生児期の骨端部には成長板(growth plate)と呼ばれる軟骨前駆細胞の集積部位が存在する。この前駆細胞は将来の骨と関節軟骨を形成する能力を保有している。今回の研究でユーインング肉腫の発生母地として同定されたeSZ (embryonic superficial zone = 胎児性表層帯)細胞は、成長板の最表層に存在し、PTHLHやGDF5、ERG、Lubricin等の軟骨前駆細胞に特異的なマーカーを発現している。本研究では、eSZ細胞をマイクロダイセクションという手法を使って採取しているが、さらにPTHLH蛋白に対する抗体を用いて、より純度の高いeSZ細胞を精製すると、ユーイング肉腫の発生は急速に促進されることが分かった。
注3)転写因子:
遺伝子DNAからメッセンジャーRNAを産生する転写作用を調節する因子。比較的短いが特異的なDNA配列に結合する領域を有していて、この性質を利用することで自身の標的遺伝子に結合して、さらに転写共役因子と会合することによって、遺伝子発現を時間的・空間的に調節している。但し、染色体上に存在するDNA配列に結合するに際しては、ヒストンの修飾状態やDNAのメチル化状態などエピゲノムの状況が大きく影響している。
論文名、著者およびその所属
○論文名
Ewing’s sarcoma precursors are highly enriched in embryonic osteochondrogenic progenitors
○ジャーナル名
Journal of Clinical Investigation
○著者
Miwa Tanaka1, Yukari Yamazaki1, Yohei Kanno1, Katsuhide Igarashi2, Ken-ichi Aisaki2, Jun Kanno2 & Takuro Nakamura1*
* 責任著者(中村 卓郎)
○著者の所属機関
1 がん研究会 がん研究所 発がん研究部
2 国立医薬品食品衛生研究所 安全性生物試験研究センター 毒性部
お問い合わせ先
【本研究の内容に関すること】
公益財団法人がん研究会 がん研究所 発がん研究部
中村 卓郎
TEL:03-3570-0462 FAX:03-3570-0463
e-mail: takuro-ind@umin.net
【取材に関すること】
公益財団法人がん研究会 広報部
本山、大関
TEL:03-3520-0111 FAX:03-3520-0141
e-mail: kouhouka@jfcr.or.jp
関連PDF
- 新しいモデルマウスを用いてユーイング肉腫の発生母地を同定することに成功
 (390.1KB )
(390.1KB )