研究内容
正常なヒトの体細胞をin vitroで培養すると一定の回数細胞分裂を繰り返した後に分裂寿命を迎え細胞分裂を不可逆的に停止します。この現象は細胞老化と呼ばれ、古くから癌抑制や個体老化の基礎機構として働いている可能性が示唆されてきました(Hayflick et al., Exp. Cell Res., 1961)(図-1)。 近年、分裂寿命のみならず癌遺伝子の発現、酸化的ストレス、DNAダメージなど様々な発癌の危険性のあるストレス(発癌ストレス)によっても細胞老化と類似の増殖停止が誘導されることが明らかになり、細胞老化は発癌の危険性を排除するために働く安全装置(癌抑制機構)である可能性が指摘されています(図-1)。
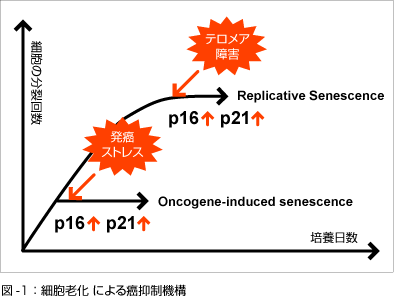
我々はこれまで、細胞老化の誘導に癌抑制遺伝子であるp16INK4a遺伝子が重要な役割を果たしており、発癌ストレスに反応して発現し、細胞老化を誘導することにより、異常細胞の増殖を防いでいることを明らかにしてきました (Hara et al., Mol. Cell. Biol., 1996; Ohtani et al., Nature, 2001; Ohtani et al., J. Cell Biol., 2003) 。しかし、その一方で、p16INK4a遺伝子発現及びそれに伴う細胞老化の誘導は培養条件に大きく影響を受けることから、細胞老化の生体内での役割については懐疑的な意見も多く、これまであまり注目されてきませんでした。しかし、最近、幾つかの良性腫瘍でp16INK4a遺伝子の発現亢進と細胞老化の形態的特徴が観察され、細胞老化が生体内でも起こりうる現象であることが認識されるようになってきました (Sharpless & DePinho, Nature, 2005)。更に、p16INK4a遺伝子ノックアウトマウスを用いた解析から、p16INK4aが幾つかの組織幹細胞において加齢による自己複製能の低下の原因となっていることが報告され(Beausejour & Campisi, Nature 2006)、細胞老化の生体内での役割、「特に癌抑制と個体老化における役割」、が再び注目されています。私たちの研究室では細胞老化誘導の中心的な役割を担うp16INK4a-RB経路とp53- p21Waf1/Cip1/Sdi1経路を中心にその作用機序の解明を通して発癌と個体老化の関係を明らかにすることを目指しています。







