細胞老化の誘導及び維持機構
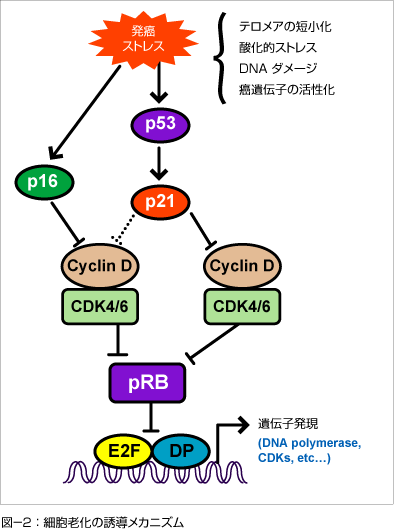
細胞老化を起こした細胞(老化細胞)の多くが細胞周期のG1期に停止し、もはやDNA合成を開始することが出来ないことが知られています。これは通常、増殖刺激に応答して活性化し、RB蛋白質の機能を失活させるはずのサイクリン依存性キナーゼ (CDKs) が老化細胞では失活しているためです。多くの場合、この原因はCDKインヒビターであるp16INK4a やp21Waf1/Cip1/Sdi1の発現レベルが上昇することにあります。 p21Waf1/Cip1/Sdi1とp16INK4aは標的とするCDKが異なるため、それぞれ単独ではRB蛋白質を活性化させる能力は弱いのですが、2つが同時に働くことで、RB蛋白質を恒常的に活性化させ細胞周期のG1期からS期への進行を停止させると考えられています(図-2)。 しかし、一旦完全に細胞老化を起こすと、その後RB蛋白質を失活させても、DNA合成は再開しますが細胞分裂を完了することはできないことから、RB蛋白質が十分に活性化されると、もはやRBに依存しない不可逆的な増殖抑制機構が発動されると考えられます。
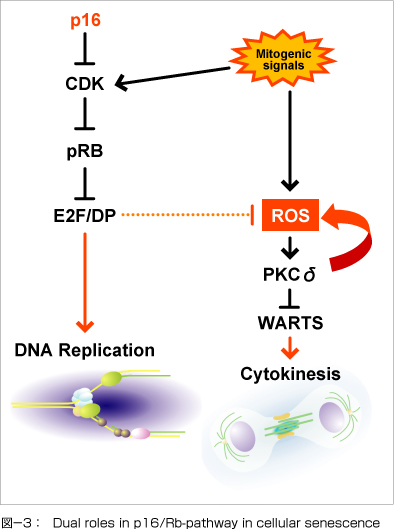
最近、我々は増殖シグナルの存在下でRB蛋白質が十分に活性化されると、その標的因子であるE2F/DP1転写因子複合体の活性が著しく低下するために、活性酸素種(ROS)の産生が上昇し、ROSの標的分子であるPKCδが活性化されることを見出しました。 更にPKCδにはROSの産生を促進する作用があるため、一旦ROSのレベルが上昇すると、PKCδが恒常的に維持されるようになることで、細胞質分裂に必要なWARTS(LATS1)の発現量が減少して、細胞質分裂ができなくなることを明らかにしました (Takahashi et al., Nature Cell Biol., 2006)。 このことは老化細胞においてはG1期だけでなく、細胞周期の複数のチェックポイントで、増殖抑制機構が働いていることを示しており、細胞老化が如何に強力な増殖抑制機構であるかを示しています(図-3)。 現在我々は、細胞老化における細胞質分裂阻害機構の詳細とその異常と発癌との関係を解析しています。