研究内容
がんの発生及び進展には、ゲノムDNAの変異に加えて、遺伝子の発現異常による、いわゆるエピジェネティックな変化が深く関わっています。真核生物のゲノムDNAは、クロマチンを形成して何重にも折りたたまれ、細胞核の3次元空間に収納されています。近年、タンパク質をコードしないノンコーディングRNAや、クロマチンの基本因子であるヒストンが、エピジェネティクス因子として機能を担うことが明らかとなり、発生、分化、疾患を理解する上で注目されています。私達は、がんにおける細胞核とクロマチンの構造と機能、を理解することを目的として、次の研究を主軸にすすめます。(1)乳がんの治療抵抗性獲得(再発)に関わるノンコーディングRNAエレノアによるクロマチン制御、(2)細胞核内構造体の形成機序、(3)ヒストンの動態制御、(4)機械学習を用いた画像の定量解析と細胞状態の評価・予測。これらの研究により、細胞核とクロマチン構造のがん制御への寄与を明らかにし、新たな診断法の確立や創薬へと道筋をつけることに貢献します。
(1)再発乳がんに関わるノンコーディングRNAエレノアの解析
乳がんの約70%はER(エストロゲン受容体)陽性型で、女性ホルモンのエストロゲンによりがんが増殖します。そのため、エストロゲンを働かないようにする内分泌療法が、標準的治療法の一つとして行われています。しかし、一部の乳がんでは内分泌療法に対する抵抗性を獲得し、再発し、治療困難となることが問題となっています。私たちは、この再発乳がんのエピジェネティクス*1に着目し研究を行なっています。これまでに、再発乳がんに特異的に発現しているノンコーディングRNA*2である、エレノアRNAを同定しています(図1)。エレノアRNAは、細胞核内に留まることで機能を発揮し、再発乳がんの増殖に必須であることを見出しています。そのため、エレノアRNAは、再発乳がんの診断・治療標的となると考え、研究を行なっています。
*1エピジェネティクス: DNAの塩基配列の変化を伴わない細胞や個体の表現型の変化と継承に関する学問。主な機序に遺伝子発現の制御と伝達システムがある。
*2ノンコーディングRNA: タンパク質に翻訳されないRNA。大規模ゲノム解析により、生体内には機能未知のノンコーディングRNAが多数あること、そのうちのいくつかはがんの重要な制御因子であることがわかりつつある。
関連論文:
Tomita S et al, Wiley Interdisciplinary Review RNA, 2016; Tomita S et al, Nat. Commun, 2015ほか
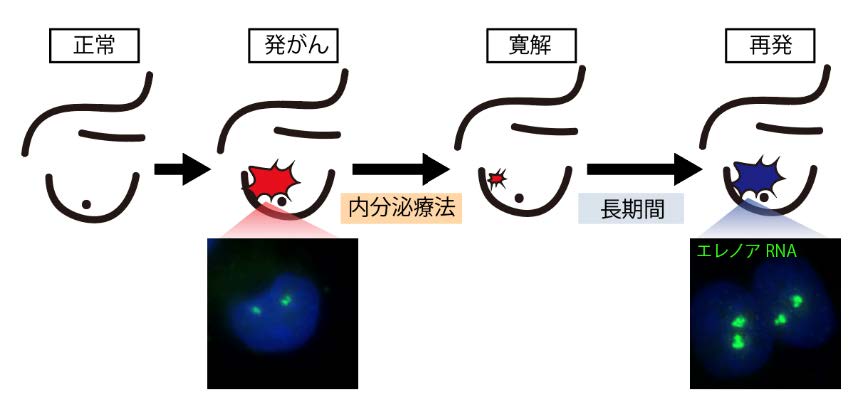
図1. ER陽性乳がん
発がんと再発に伴い、エレノアRNAが核内に出現し、ESR1遺伝子(ERをコードする遺伝子)の発現を活性化する。それによりがんの増殖、再発(内分泌療法抵抗性の獲得)に至る。
(2) 細胞核内構造体の形成機序と機能の解明
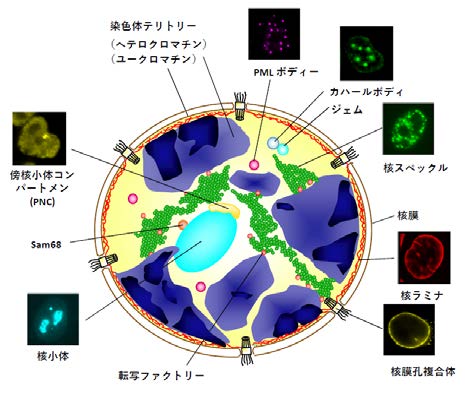
真核生物のゲノムDNAは、クロマチンを形成して細胞核内に収納されています。クロマチン周辺には、核小体や核スペックルなど膜に囲まれていない構造体が複数存在します(図2)。核内構造体はRNAとタンパク質群からなる超分子複合体で、特定因子が局所に蓄積しつつ、ダイナミックに移動し機能を発現しやすくする場で、近隣にあるクロマチンの制御に密接に関わると考えられます。また近年、核内構造体は、ノンコーディングRNAを“種”として、RNA結合タンパク質が局所的に集合することで引き起こされる液相分離(liquid-liquid phase separation)という物理現象によるものであることが提唱されはじめました。
クロマチンは細胞核内で、多階層にわたっておりたたまれて、ドメインやコンパートメントといった3次元構造を形成し、また、核内構造体と相互作用しながら存在します(図3)。私たちは、核内構造体および高次クロマチン構造の形成機序と、その遺伝子発現制御、さらにはがんへの寄与を理解することをめざします。
関連論文:
Saitoh N et al, Mol. Biol. Cell, 2016; Aoto T et al, J. Biol. Chem, 2008; Saitoh N et al, Mol. Biol. Cell, 2004 ほか
図
図2. 細胞核内構造
様々な核内構造体のモデル図と、免疫染色画像
(蛋白質 核酸 酵素51, 2006・臨床検査52, 2008より改変)
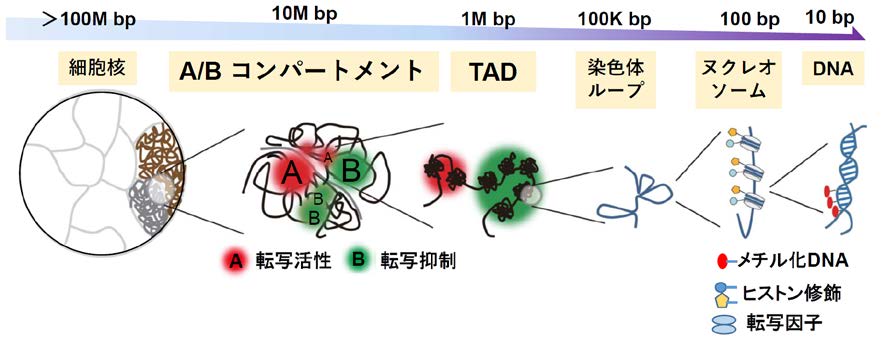
図3. 細胞核内でのクロマチンのおりたたみ構造
(3) ヒストンタンパク質の動態によるクロマチン・がんの制御機構の解析
クロマチンの基本単位であるヌクレオソームを構成する4種類のヒストンタンパク質(H2A, H2B, H3, H4)は、クロマチンによる遺伝子発現制御機構に重要な役割を果たしています。ヒストンは、翻訳後修飾(アセチル化・メチル化など)をうけますが、何番目のアミノ酸にどの化学修飾(アセチル化・メチル化など)が入るかによって転写を抑制するのか、活性化するのかが変わります。また、ヒストンには相同性の高いバリアントが多数存在し(H3.3、H2A.Zなど)、クロマチンの遺伝子発現制御に機能しています。これらのヒストンバリアントやヒストン修飾は、多くのがん細胞において発現量や存在量の異常が見つかっており、細胞のがん化に伴う遺伝子発現プロファイルの変化と関係していると考えられます。そこで、私たちは、ヒストンバリアントやヒストン修飾の動態(ダイナミクス)を解析することで、クロマチンやがんの制御機構を解析しています。
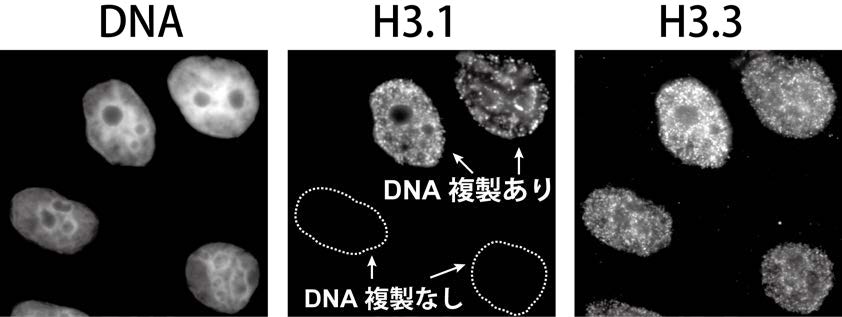
図4. ヒストンH3.1とH3.3の異なるダイナミクス
H3.1はDNA複製に伴いクロマチンに取り込まれるが、H3.3は細胞周期に依らずにクロマチンに取り込まれることが、1細胞レベルで分かる。
(4) 機械学習を用いた画像の定量解析と細胞状態の評価・予測
細胞核内構造体とクロマチンの形態は、分化やストレス応答、疾患などで顕著に変化します。臨床病理においては、がんに特徴的な核形態の変化(核異形とよばれます)は、確定診断の指標として用いられてきました。しかし今まで、核の形態変化を定量・計測できる汎用性のある方法はほとんどありませんでした。私たちは、AI (artificial intelligence)の一種である、機械学習によるパターン認識アルゴリズムwndchrm*3を用いて、細胞・組織形態の定量化を行い、細胞状態の評価や予測を行います。これは、wndchrmを開発したIlya Goldberg 博士らとの共同研究です。
この手法では、例えば、正常と変異細胞画像群について、それぞれ4000以上の画像形態の特徴値が自動計算され、それぞれの違いを見分けるための最適な特徴群が自動抽出され、分類器が作成されます。この過程で、分類精度と形態の変化度や方向性が算出されます。分類器をもとに、未知の細胞が、どのような細胞のクラスに属するのかを推定することもできます。
wndchrmによる解析をもとに、基礎研究の様々な生物学的問題に対応できる、汎用性ある形態の解析手法を確立します。また、医療画像の補助的診断や薬剤スクリーニングへの道筋をつけることにも意欲的です。
*3Weighted neighbor distance using a compound hierarchey of algorithms representing
morphologyの略(ウィンチャームと発音)
関連論文:
Takagi et al, J. Cell Sci, 2018: Ono T et al, Mol. Biol. Cell, 2017; Matsumoto A et al, Nucleus, 2016; Tokunaga K et al, Sci. Rep, 2014; Shamir L et al, PLoS Comp Biol, 2010 ほか
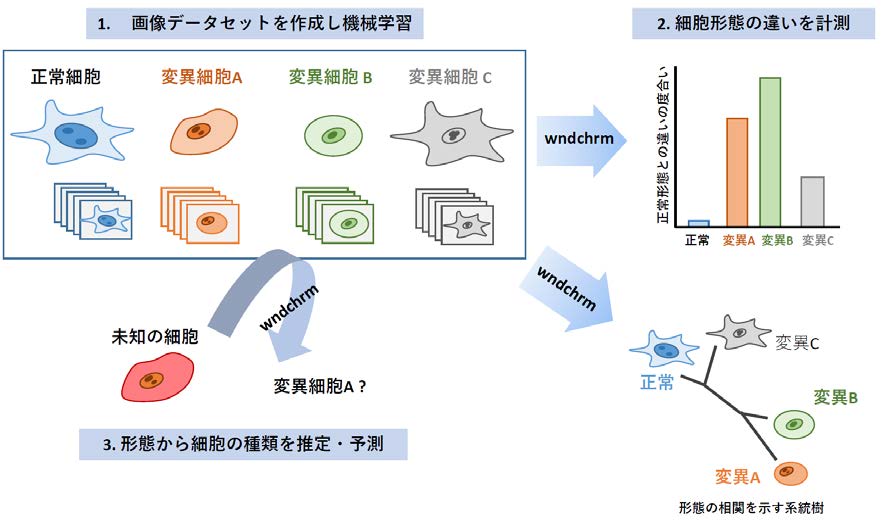
図5. 機械学習アルゴリズムwndchrmを用いた画像解析 形態の定量化、類似度の計測、細胞状態の推定などができる
