胞巣状軟部肉腫の動物モデルを作製:新たながんの転移機構を発見
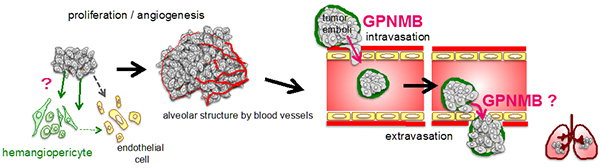
このたび、がん研究所 発がん研究部 田中美和 研究員と、中村卓郎 部長、および病理部の研究グループが、胞巣状軟部肉腫(ASPS)の新たな動物モデルの作製に成功し、がんの転移機構の解明につながる新事実を見出しました。 ASPSは、思春期から若年成人に発生する軟部悪性腫瘍で、発育は比較的緩やかですが、高頻度で血行性の転移を示す難治性の稀少がんです。この高転移能の原因として、腫瘍内の豊富な血管形成が従来から指摘されていました。本研究では、ASPSのex vivoマウスモデルを作製しましたが、このモデルにおいても腫瘍血管構築が高度であり、腫瘍細胞の血管侵襲や高転移能が再現出来ました。また、ASPSの血管に密に存在する血管周皮細胞(ペリサイト)が転移に重要な役割を担っていることが示されました。今回確立されたマウスモデルは、ASPSの発生機構や病態解析に有用であるばかりではなく、がんの転移機構の解明に新たな一石を投じるものでもあり、がん転移に対する新たな予防・治療方法に途を開くことが期待されます。
詳細
今回私たちは、ASPSの原因融合遺伝子であるASPSCR1-TFE3をマウス胎児の間葉系細胞に導入し、ヌードマウスの皮下に移植するex vivoモデルを作製しました。その結果、ヒトのASPSを極めて良く反映する腫瘍が100%の確率で発生しました。多くのマウスにおいてASPSは肺に多発性の転移を形成しました。その原因として、ヒトASPSと同様の豊富な血管構築と腫瘍細胞の血管侵襲が挙げられます。多くのがんでは血管形成は不完全でペリサイトの誘導が不十分ですが、それとは対照的にASPSモデルの血管ではペリサイトが豊富であり、この現象はヒトASPSでも確認されました。また、血管内においてASPS細胞群がペリサイトに周囲を被われる特異な構造が観察されました。面白いことに、ASPS細胞のみをマウスの尾静脈から注射しても、転移は形成されません。このことから、ASPSの転移には腫瘍細胞が血管内でペリサイトに防御されていることが必要と考えられました。
一方、ASPS細胞の血管侵襲に際してはASPSCR1-TFE3の標的遺伝子GPNMBの高発現が関与していることが示されました。事実GPNMBをノックダウンすると、ASPS細胞による血管内皮の透過性が阻害されました。
このASPSマウスモデルを立ち上げたことにより、融合遺伝子を構成するTFE転写因子ファミリーの発がん作用を比較することも可能になりました。ASPSCR1と融合させるとTFE3の他にTFEBにも発がん作用があり、TFECとMITFにはないことがわかりました。この結果から、TFE3とTFEBに共通に存在する機能モチーフとそこに結合する共役因子の存在が示唆されます。
ASPSと同様の転移様式を示すがんは、腎細胞がんなど他にもあることが予想されることから、今回の研究成果を基礎として、がんの転移を標的とした新たな治療法の検討も行う予定です。また、TFEファミリーの発がんにおける分子機構のさらなる理解を目指して研究を進めます。
- 1) Tanaka, M., Homme, M., Yamazaki, Y., Shimizu, R., Takazawa, Y., and Nakamura, T. Modeling alveolar soft part sarcoma unveils novel mechanisms of metastasis. Cancer Research Published OnlineFirst December 15, 2016 DOI: 10.1158/0008-5472 CAN-16-2486