【ニュースリリース】ALKおよびROS1融合遺伝子陽性肺がんの新たな分子標的薬抵抗性機構を発見 〜MIG6欠損によるALK/ROS1阻害薬耐性機構〜
2023年11月06日
1.ポイント
●ALK融合遺伝子陽性の非小細胞肺がんの患者さんより樹立したがん細胞株を用いて、ALK阻害薬に対する薬剤抵抗性メカニズムをCRISPR/Cas9によるスクリーニングで解析し、MIG6の欠損が関与していることを明らかにしました。
●MIG6を欠損した肺がん細胞では、ごく微量のEGFでもEGFRが活性化し、ALK阻害薬やROS1阻害薬への抵抗性が生じることを明らかにしました。
●MIG6の欠損による耐性は、抗EGFR抗体薬とALK阻害薬またはROS1阻害薬を併用することで克服できる可能性を実験的に示しました。
2.研究の概要
非小細胞肺がんは肺がんの85%程度を占めますが、その中でもALK(注1)やROS1(注2)融合遺伝子が検出される症例がそれぞれ4%および1%程度存在します。これらの患者さんではALKやROS1を標的とした分子標的薬(ALK阻害薬、ROS1阻害薬:注3)が高い効果を示すことが知られています。しかし、治療開始当初は腫瘍の大幅な縮小を認めても数年程度経過すると薬剤が効かなくなってしまう薬剤耐性を獲得し、がんは再び増悪・進行してしまいます。
がん研究会の片山量平(がん化学療法センター 基礎研究部 部長)、近藤信幸(同研究部所属、東京医科歯科大学医歯学総合研究科博士課程 大学院生)らの研究グループは、ALK融合遺伝子陽性肺がん患者さんから樹立したがん細胞株を用いて、CRISPR/Cas9によるスクリーニング(注4)を実施し、ALK阻害薬が存在してもがん細胞が生き延びてしまう現象に関わる遺伝子を探索しました。その結果、EGF受容体(EGFR)に結合するタンパク質MIG6をコードするERRFI1遺伝子を失うと、ALK阻害薬が効きにくくなることを発見しました。詳細な解析によってMIG6を欠損したALK肺がん細胞では、ごく低濃度の増殖因子(EGFなど)によってEGFRの活性化が誘導され、ALK阻害薬に抵抗性を生じることが明らかになりました。このMIG6欠損による耐性は、ALK阻害薬と抗EGFR抗体薬を併用することで、EGFRからの増殖シグナルが抑制されて耐性を克服できる可能性を確認し、動物実験でも十分な治療効果を認めました。さらに同様の薬剤耐性メカニズムはROS1融合遺伝子陽性の肺がん細胞でも生じることを実験的に示しました。
本研究から、ALKまたはROS1融合遺伝子陽性の肺がん におけるALK/ROS1阻害薬抵抗性メカニズムの1つとしてMIG6の欠損を見出しました。抗EGFR抗体薬とALK/ROS1阻害薬の併用療法により抵抗性を克服できる可能性が基礎研究レベルで明らかにされ、今後の治療法開発に貢献しうる研究成果であると考えます。
3.論文名、著者およびその所属
○論文名: MIG6 loss confers resistance to ALK/ROS1 inhibitors in NSCLC through EGFR pathway by low-dose EGF
○ジャーナル名
JCI insight
○著者
Nobuyuki Kondo1,2, Takahiro Utsumi1,3, Yuki Shimizu1,4, Ai Takemoto1, Tomoko Oh-hara1, Ken Uchibori5, Sophia Subat-Motoshi6,7, Hironori Ninomiya6, Kengo Takeuchi6,7, Makoto Nishio5, Yasunari Miyazaki2, and Ryohei Katayama1,4,*
(* 責任著者)
○著者の所属機関
1.公益財団法人がん研究会 がん化学療法センター 基礎研究部
2.東京医科歯科大学 呼吸器内科
3.九州大学 呼吸器内科
4.東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻
5.公益財団法人がん研究会 がん研有明病院 呼吸器内科
6.公益財団法人がん研究会 がん研究所 病理部
7.公益財団法人がん研究会 がん研究所 分子標的病理プロジェクト
4.研究の詳細
背景
ALK、およびROS1融合遺伝子*1,2は非小細胞肺癌のそれぞれ約4%、1%で存在することが知られています。多くの症例では分子標的薬であるALK、ROS1チロシンキナーゼ阻害薬*3により高い治療効果が認められます。しかし、数年以内に薬剤耐性がんの出現により再増悪してしまうことが問題となっています。薬剤耐性のメカニズムとしては阻害薬が結合するALKやROS1チロシンキナーゼ領域の二次変異と、EGFRやMETに代表されるバイパス経路の活性化が知られています。またNF2やMED12などのがん抑制遺伝子が喪失することで耐性が生じることも報告されています。一方で耐性メカニズムが不明である症例も多く、一部のチロシンキナーゼ領域の二次変異を除いて耐性時にも有効な治療法は確立していません。そこで本研究グループでは独自に患者検体から樹立したALK陽性肺がん細胞株を用いてCRISPR/Cas9によるゲノムワイドスクリーニング*4を実施し、新規の薬剤耐性メカニズムの探索と克服法の解明を目指して研究を行いました。
研究内容
はじめに、がん研究会の倫理審査委員会承認済みのプロトコールに則り同意の得られた肺がん患者さんから、検査などの残余組織検体を頂き、がん細胞株の樹立を行いました。樹立したがん細胞株の1つであるJFCR-028-3細胞は、ALK阻害薬に高い感受性を示しました。ALK陽性肺がんにおけるALK阻害薬抵抗性のメカニズムを新たに探索するため、レンチウイルスベクターを用いてCas9を安定的に発現する細胞株を樹立しました。網羅的に全ゲノム遺伝子を欠損させるガイドRNA(sgRNA)ライブラリを導入し、ALK阻害薬を9日間処理した後に生き残った細胞からDNAを抽出し、sgRNAを次世代シーケンサで解析しました。ALK阻害薬を処理していない細胞が保持していたsgRNAと比較してALK阻害薬の処理によって濃縮されたsgRNAの標的遺伝子を探索したところ、既知のがん抑制遺伝子であるNF2やMED12に加えて、新たにERRFI1遺伝子が同定されました。ERRFI1がコードするMIG6タンパク質は、EGFRに結合しその活性を負に制御することが知られています。そこで、本研究では特にMIG6に着目して研究を行いました。
図 1 .CRISPR/Cas9スクリーニングの概要
TogoTV (© 2016 DBCLS TogoTV, CC-BY-4.0 https://creativecommons.org/licenses/by/4.0/deed.ja )のイラストを使用しました。
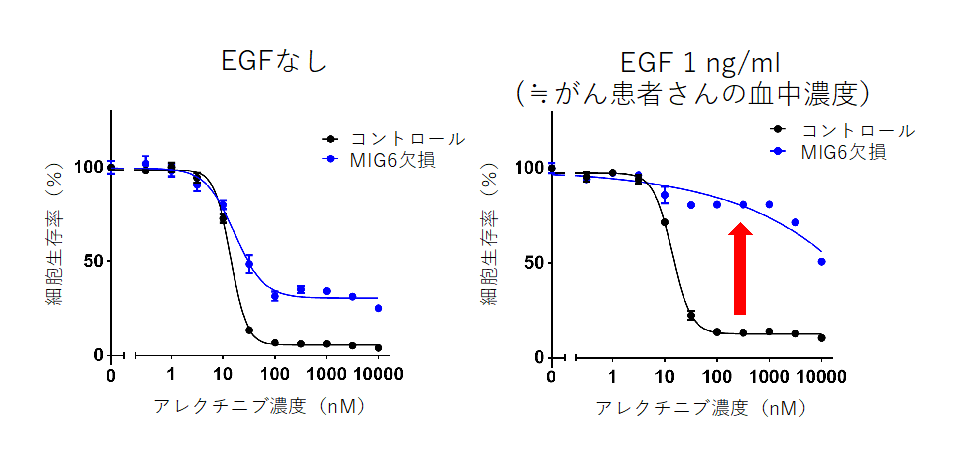
クリーニングで同定されたMIG6について、複数のsgRNAを用いてノックアウト細胞をそれぞれ樹立したところ、いずれもALK阻害薬にやや抵抗性を認めました。MIG6はEGFRのチロシンキナーゼ領域に結合することで活性を阻害することが知られているため、次に、EGFRに結合する増殖因子であるEGFやTGFαを用いて刺激し、下流シグナルの変化や薬剤感受性の変化等の解析を行いました。健常人の血中濃度に相当する微量のEGFで刺激してもコントロールのALK陽性肺がん細胞株JFCR-028-3細胞ではALK阻害薬感受性に変化はありませんでした。しかしMIG6を欠損させたJFCR-028-3細胞では、微量のEGFを添加するだけでEGFR下流の腫瘍増殖に関連するシグナルが活性化し、著明にALK阻害薬耐性となることが明らかになりました。
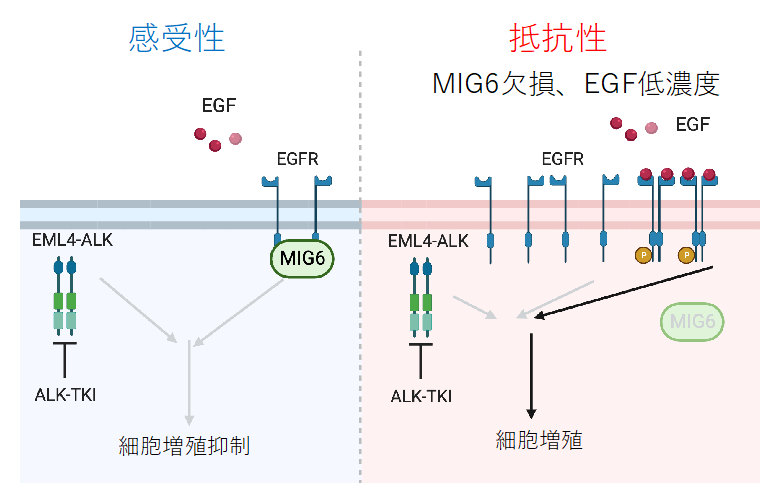
そこで、MIG6欠損による耐性にはEGFとEGFRの結合が重要であると考え、そのリガンド‐受容体結合を阻害しEGFR活性化を抑制することでALK阻害薬抵抗性を克服できるのではないかと考えました。抗EGFR抗体薬であるパニツムマブとALK阻害薬を併用することで、ALK阻害薬感受性が回復し、耐性を克服できることが実験的に明らかになりました。マウスゼノグラフトモデルを用いた動物実験でもMIG6を欠損させることでALK阻害薬の1つであるアレクチニブへの耐性が生じやすくなり、EGFR抗体薬パニツムマブを同時に投与することで高い治療効果を発揮し、耐性腫瘍の出現を遅らせられることが確認されました。さらに臨床検体を解析した結果、ALK阻害薬に耐性となった後に採取された検体では、ALK阻害薬未治療時の検体と比較してMIG6の発現が低下している症例も存在することが判明しました。
最後に、ALKS1とROのチロシンキナーゼ領域の構造は非常によく似ているため、MIG6欠損の治療抵抗のメカニズムがROS1陽性の非小細胞が肺がんでも生じうるのではないかと予想しました。ROS1陽性肺がん患者さんより樹立した細胞株でも同様の実験を行ったところMIG6を欠損させることでROS1阻害薬抵抗性を生じ、パニツムマブとの併用療法が有効であることが確認されました。MIG6の発現が低いROS1陽性肺がん細胞株では、低濃度のEGFによる刺激でも治療抵抗性を生じやすい傾向でしたが、MIG6を過剰発現させることで耐性を生じにくくなることが明らかになりました。
本研究から、ALK、およびROS1融合遺伝子陽性肺がんにおいて、MIG6の欠損がEGFRシグナルの活性化を介してALK、ROS1阻害薬抵抗性に関与する可能性を基礎研究レベルで示し、抗EGFR抗体薬併用による耐性克服の可能性について報告しました。
5.本研究への支援
本研究は、下記機関・財団より資金的支援等を受けて実施されました。
・国立研究開発法人 日本医療研究開発機構(AMED) 次世代がん医療加速化研究事業(P-PROMOTE)
・JST 次世代研究者挑戦的研究プログラム 研究助成
・日本学術振興会 科学研究費
・日本財団研究助成
・公益財団法人 中外創薬科学財団 特別研究助成
ほか
6.用語解説
(*1) ALK融合遺伝子
未分化リンパ腫キナーゼ (Anaplastic lymphoma kinase :ALK)遺伝子がコードするALKタンパク質は受容体型チロシンキナーゼです。がん細胞の中には染色体転座や逆位などの現象により、EML4などの遺伝子とALK遺伝子が融合遺伝子を形成する場合があります。融合遺伝子形成により恒常的にALK融合タンパク質が発現するとともに、多量体形成を介して、恒常的にALKキナーゼが活性化されることでがん化が促進されると考えられています。
(*2) ROS1融合遺伝子
ROS1 (ROS proto-oncogene 1)遺伝子がコードするROS1タンパク質は受容体型チロシンキナーゼとして知られています。ALK融合遺伝子と同様、CD74などの遺伝子と染色体転座や逆位などの現象により融合遺伝子を形成する場合があり、恒常的発現の誘導と多量体形成などを介して、恒常的にROS1キナーゼが活性化され、がん化が促進されると考えられています。
(*3) ALK、ROS1阻害薬
ALK、ROS1融合タンパク質のキナーゼ活性を抑制する分子標的薬です。本邦においては、ALK阻害薬としてクリゾチニブ、アレクチニブ、セリチニブ、ブリグチニブ、ロルラチニブの5剤が承認されています。ROS1阻害薬としてクリゾチニブ、エヌトレクチニブの2剤が承認されています。ALKとROS1のチロシンキナーゼ領域の構造は非常によく似ているため、一部の薬剤、例えばクリゾチニブではALKとROS1の両方のキナーゼ活性を阻害することが可能です。
(*4) CRISPR/Cas9スクリーニング
CRISPR/Cas9は大腸菌由来のCas9タンパク質とsgRNAを組み合わせた遺伝子編集技術です。標的遺伝子の配列に合わせたsgRNAを設計することでCas9タンパク質がsgRNAと結合した二本鎖DNAを切断します。それにより、簡便かつ高精度に目的遺伝子からのたんぱく質発現を喪失させることが可能です。この技術を応用してヒトの全遺伝子(約2万)を対象にノックアウト細胞を作成し、薬剤処理などの介入後に次世代シーケンサでsgRNAを解析することにより原因遺伝子を特定するといったことが可能となる研究手法です。
●ALK融合遺伝子陽性の非小細胞肺がんの患者さんより樹立したがん細胞株を用いて、ALK阻害薬に対する薬剤抵抗性メカニズムをCRISPR/Cas9によるスクリーニングで解析し、MIG6の欠損が関与していることを明らかにしました。
●MIG6を欠損した肺がん細胞では、ごく微量のEGFでもEGFRが活性化し、ALK阻害薬やROS1阻害薬への抵抗性が生じることを明らかにしました。
●MIG6の欠損による耐性は、抗EGFR抗体薬とALK阻害薬またはROS1阻害薬を併用することで克服できる可能性を実験的に示しました。
2.研究の概要
非小細胞肺がんは肺がんの85%程度を占めますが、その中でもALK(注1)やROS1(注2)融合遺伝子が検出される症例がそれぞれ4%および1%程度存在します。これらの患者さんではALKやROS1を標的とした分子標的薬(ALK阻害薬、ROS1阻害薬:注3)が高い効果を示すことが知られています。しかし、治療開始当初は腫瘍の大幅な縮小を認めても数年程度経過すると薬剤が効かなくなってしまう薬剤耐性を獲得し、がんは再び増悪・進行してしまいます。
がん研究会の片山量平(がん化学療法センター 基礎研究部 部長)、近藤信幸(同研究部所属、東京医科歯科大学医歯学総合研究科博士課程 大学院生)らの研究グループは、ALK融合遺伝子陽性肺がん患者さんから樹立したがん細胞株を用いて、CRISPR/Cas9によるスクリーニング(注4)を実施し、ALK阻害薬が存在してもがん細胞が生き延びてしまう現象に関わる遺伝子を探索しました。その結果、EGF受容体(EGFR)に結合するタンパク質MIG6をコードするERRFI1遺伝子を失うと、ALK阻害薬が効きにくくなることを発見しました。詳細な解析によってMIG6を欠損したALK肺がん細胞では、ごく低濃度の増殖因子(EGFなど)によってEGFRの活性化が誘導され、ALK阻害薬に抵抗性を生じることが明らかになりました。このMIG6欠損による耐性は、ALK阻害薬と抗EGFR抗体薬を併用することで、EGFRからの増殖シグナルが抑制されて耐性を克服できる可能性を確認し、動物実験でも十分な治療効果を認めました。さらに同様の薬剤耐性メカニズムはROS1融合遺伝子陽性の肺がん細胞でも生じることを実験的に示しました。
本研究から、ALKまたはROS1融合遺伝子陽性の肺がん におけるALK/ROS1阻害薬抵抗性メカニズムの1つとしてMIG6の欠損を見出しました。抗EGFR抗体薬とALK/ROS1阻害薬の併用療法により抵抗性を克服できる可能性が基礎研究レベルで明らかにされ、今後の治療法開発に貢献しうる研究成果であると考えます。
3.論文名、著者およびその所属
○論文名: MIG6 loss confers resistance to ALK/ROS1 inhibitors in NSCLC through EGFR pathway by low-dose EGF
○ジャーナル名
JCI insight
○著者
Nobuyuki Kondo1,2, Takahiro Utsumi1,3, Yuki Shimizu1,4, Ai Takemoto1, Tomoko Oh-hara1, Ken Uchibori5, Sophia Subat-Motoshi6,7, Hironori Ninomiya6, Kengo Takeuchi6,7, Makoto Nishio5, Yasunari Miyazaki2, and Ryohei Katayama1,4,*
(* 責任著者)
○著者の所属機関
1.公益財団法人がん研究会 がん化学療法センター 基礎研究部
2.東京医科歯科大学 呼吸器内科
3.九州大学 呼吸器内科
4.東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻
5.公益財団法人がん研究会 がん研有明病院 呼吸器内科
6.公益財団法人がん研究会 がん研究所 病理部
7.公益財団法人がん研究会 がん研究所 分子標的病理プロジェクト
4.研究の詳細
背景
ALK、およびROS1融合遺伝子*1,2は非小細胞肺癌のそれぞれ約4%、1%で存在することが知られています。多くの症例では分子標的薬であるALK、ROS1チロシンキナーゼ阻害薬*3により高い治療効果が認められます。しかし、数年以内に薬剤耐性がんの出現により再増悪してしまうことが問題となっています。薬剤耐性のメカニズムとしては阻害薬が結合するALKやROS1チロシンキナーゼ領域の二次変異と、EGFRやMETに代表されるバイパス経路の活性化が知られています。またNF2やMED12などのがん抑制遺伝子が喪失することで耐性が生じることも報告されています。一方で耐性メカニズムが不明である症例も多く、一部のチロシンキナーゼ領域の二次変異を除いて耐性時にも有効な治療法は確立していません。そこで本研究グループでは独自に患者検体から樹立したALK陽性肺がん細胞株を用いてCRISPR/Cas9によるゲノムワイドスクリーニング*4を実施し、新規の薬剤耐性メカニズムの探索と克服法の解明を目指して研究を行いました。
研究内容
はじめに、がん研究会の倫理審査委員会承認済みのプロトコールに則り同意の得られた肺がん患者さんから、検査などの残余組織検体を頂き、がん細胞株の樹立を行いました。樹立したがん細胞株の1つであるJFCR-028-3細胞は、ALK阻害薬に高い感受性を示しました。ALK陽性肺がんにおけるALK阻害薬抵抗性のメカニズムを新たに探索するため、レンチウイルスベクターを用いてCas9を安定的に発現する細胞株を樹立しました。網羅的に全ゲノム遺伝子を欠損させるガイドRNA(sgRNA)ライブラリを導入し、ALK阻害薬を9日間処理した後に生き残った細胞からDNAを抽出し、sgRNAを次世代シーケンサで解析しました。ALK阻害薬を処理していない細胞が保持していたsgRNAと比較してALK阻害薬の処理によって濃縮されたsgRNAの標的遺伝子を探索したところ、既知のがん抑制遺伝子であるNF2やMED12に加えて、新たにERRFI1遺伝子が同定されました。ERRFI1がコードするMIG6タンパク質は、EGFRに結合しその活性を負に制御することが知られています。そこで、本研究では特にMIG6に着目して研究を行いました。

図 1 .CRISPR/Cas9スクリーニングの概要
TogoTV (© 2016 DBCLS TogoTV, CC-BY-4.0 https://creativecommons.org/licenses/by/4.0/deed.ja )のイラストを使用しました。
クリーニングで同定されたMIG6について、複数のsgRNAを用いてノックアウト細胞をそれぞれ樹立したところ、いずれもALK阻害薬にやや抵抗性を認めました。MIG6はEGFRのチロシンキナーゼ領域に結合することで活性を阻害することが知られているため、次に、EGFRに結合する増殖因子であるEGFやTGFαを用いて刺激し、下流シグナルの変化や薬剤感受性の変化等の解析を行いました。健常人の血中濃度に相当する微量のEGFで刺激してもコントロールのALK陽性肺がん細胞株JFCR-028-3細胞ではALK阻害薬感受性に変化はありませんでした。しかしMIG6を欠損させたJFCR-028-3細胞では、微量のEGFを添加するだけでEGFR下流の腫瘍増殖に関連するシグナルが活性化し、著明にALK阻害薬耐性となることが明らかになりました。
そこで、MIG6欠損による耐性にはEGFとEGFRの結合が重要であると考え、そのリガンド‐受容体結合を阻害しEGFR活性化を抑制することでALK阻害薬抵抗性を克服できるのではないかと考えました。抗EGFR抗体薬であるパニツムマブとALK阻害薬を併用することで、ALK阻害薬感受性が回復し、耐性を克服できることが実験的に明らかになりました。マウスゼノグラフトモデルを用いた動物実験でもMIG6を欠損させることでALK阻害薬の1つであるアレクチニブへの耐性が生じやすくなり、EGFR抗体薬パニツムマブを同時に投与することで高い治療効果を発揮し、耐性腫瘍の出現を遅らせられることが確認されました。さらに臨床検体を解析した結果、ALK阻害薬に耐性となった後に採取された検体では、ALK阻害薬未治療時の検体と比較してMIG6の発現が低下している症例も存在することが判明しました。

図 2 .EGF刺激によるALK阻害薬感受性の変化
最後に、ALKS1とROのチロシンキナーゼ領域の構造は非常によく似ているため、MIG6欠損の治療抵抗のメカニズムがROS1陽性の非小細胞が肺がんでも生じうるのではないかと予想しました。ROS1陽性肺がん患者さんより樹立した細胞株でも同様の実験を行ったところMIG6を欠損させることでROS1阻害薬抵抗性を生じ、パニツムマブとの併用療法が有効であることが確認されました。MIG6の発現が低いROS1陽性肺がん細胞株では、低濃度のEGFによる刺激でも治療抵抗性を生じやすい傾向でしたが、MIG6を過剰発現させることで耐性を生じにくくなることが明らかになりました。
本研究から、ALK、およびROS1融合遺伝子陽性肺がんにおいて、MIG6の欠損がEGFRシグナルの活性化を介してALK、ROS1阻害薬抵抗性に関与する可能性を基礎研究レベルで示し、抗EGFR抗体薬併用による耐性克服の可能性について報告しました。

図3.本研究の概要 BioRenderにより作成しました。
5.本研究への支援
本研究は、下記機関・財団より資金的支援等を受けて実施されました。
・国立研究開発法人 日本医療研究開発機構(AMED) 次世代がん医療加速化研究事業(P-PROMOTE)
・JST 次世代研究者挑戦的研究プログラム 研究助成
・日本学術振興会 科学研究費
・日本財団研究助成
・公益財団法人 中外創薬科学財団 特別研究助成
ほか
6.用語解説
(*1) ALK融合遺伝子
未分化リンパ腫キナーゼ (Anaplastic lymphoma kinase :ALK)遺伝子がコードするALKタンパク質は受容体型チロシンキナーゼです。がん細胞の中には染色体転座や逆位などの現象により、EML4などの遺伝子とALK遺伝子が融合遺伝子を形成する場合があります。融合遺伝子形成により恒常的にALK融合タンパク質が発現するとともに、多量体形成を介して、恒常的にALKキナーゼが活性化されることでがん化が促進されると考えられています。
(*2) ROS1融合遺伝子
ROS1 (ROS proto-oncogene 1)遺伝子がコードするROS1タンパク質は受容体型チロシンキナーゼとして知られています。ALK融合遺伝子と同様、CD74などの遺伝子と染色体転座や逆位などの現象により融合遺伝子を形成する場合があり、恒常的発現の誘導と多量体形成などを介して、恒常的にROS1キナーゼが活性化され、がん化が促進されると考えられています。
(*3) ALK、ROS1阻害薬
ALK、ROS1融合タンパク質のキナーゼ活性を抑制する分子標的薬です。本邦においては、ALK阻害薬としてクリゾチニブ、アレクチニブ、セリチニブ、ブリグチニブ、ロルラチニブの5剤が承認されています。ROS1阻害薬としてクリゾチニブ、エヌトレクチニブの2剤が承認されています。ALKとROS1のチロシンキナーゼ領域の構造は非常によく似ているため、一部の薬剤、例えばクリゾチニブではALKとROS1の両方のキナーゼ活性を阻害することが可能です。
(*4) CRISPR/Cas9スクリーニング
CRISPR/Cas9は大腸菌由来のCas9タンパク質とsgRNAを組み合わせた遺伝子編集技術です。標的遺伝子の配列に合わせたsgRNAを設計することでCas9タンパク質がsgRNAと結合した二本鎖DNAを切断します。それにより、簡便かつ高精度に目的遺伝子からのたんぱく質発現を喪失させることが可能です。この技術を応用してヒトの全遺伝子(約2万)を対象にノックアウト細胞を作成し、薬剤処理などの介入後に次世代シーケンサでsgRNAを解析することにより原因遺伝子を特定するといったことが可能となる研究手法です。
以上
関連PDF
- ニュースリリース文書
 (1,795.3KB )
(1,795.3KB )