【ニュースリリース】DNA分解酵素TREX1を不活性化することでウイルス感染を模倣し免疫細胞からの攻撃を促進する 〜免疫チェックポイント阻害薬の奏功率改善を目指して〜
2024年02月06日
(ポイント)
●DNA分解酵素の1種であるThree Prime Repair Exonuclease 1(TREX1)の機能を不活性化することで、細胞質内にDNAが異常に蓄積し、DNAウイルス感染時に似た免疫反応が誘導される。
●マウスモデルにおいて、がん細胞のTREX1を不活性化すると、細胞傷害性T細胞などの免疫細胞ががん領域へ集積し、免疫チェックポイント阻害薬およびSTING作動薬の治療効果が増す。
●ヒトサンプルにおいて、TREX1は正常組織と比較して多くのがん組織において発現が高く、がん細胞特異的な治療標的となる可能性がある。
(概要説明)
公益財団法人がん研究会 がん研究所 細胞生物部の北嶋俊輔研究員(日本学術振興会 卓越研究員)を中心とする研究グループは、米国ダナファーバーがん研究所David A.Barbie博士らの研究グループおよび米国Gilead Sciences社との共同研究により、がん細胞において、細胞質内のDNAを認識し抗ウイルス/抗腫瘍免疫を誘導する「STING経路」が活性化することに伴い、細胞質内のDNA分解酵素の1種であるThree Prime Repair Exonuclease 1(TREX1)が増加することを明らかにしました。また、TREX1を不活性化させることで、がん細胞の細胞質内にDNAが蓄積し、がん細胞自身から免疫細胞の遊走/活性化に関わる因子が分泌されることを明らかにしました。さらに、複数のマウスモデルにおいて、がん細胞のTREX1を不活性化すると、免疫チェックポイント阻害薬およびSTING作動薬の治療効果が増すことを明らかにしました。本研究の成果は、米国学術誌「Cancer Discovery」(オンライン版)に2024年1月10日(現地時間)に公開されました。
(説明)
[背景]
国内では2015年に非小細胞肺がんに対して免疫チェックポイント阻害薬(ICI)が保険適応となり、一部の進行期肺がん患者にとって、非常に有効性が高い画期的な治療法となっています。一方で、ICIが有効な症例は2-3割にとどまり、ICI治療の有効性向上および抵抗性克服は喫緊の課題となっています。私たちは、これまでにがん細胞が免疫細胞から逃れるためのメカニズムの1つとして、DNAウイルス感染に対する自然免疫応答で主要な役割を果たす「STING経路(図1)」が、がん細胞内において不活性化されていることを報告してきました。そのため、がん細胞で不活性化されているSTING経路を効率的に再活性化することが出来れば、ICI抵抗性を克服するための良い治療戦略となる可能性があります。
[研究の内容と成果]
STING経路の活性化を誘導する新たな治療標的を探索するため、本研究では、STING経路に対する内因性の阻害(Negative Feedback)経路に着目しました。まず初めに、これまでにSTING経路を活性化する薬剤としてすでに見出していたMonopolar Spindle 1(MPS1)阻害薬を用いて、STING経路を活性化させました。次に、網羅的な遺伝子発現解析により、STING経路の活性化に伴い遺伝子発現が上昇するNegative Feedback因子候補を抽出しました。その結果、がん細胞において、STING経路が活性化することに伴い、細胞質内のDNA分解酵素の1種であるThree Prime Repair Exonuclease 1(TREX1)の遺伝子発現が上昇することを明らかにしました。TREX1は、自己免疫疾患エカルディ・グティエール症候群(AGS)の原因遺伝子としても知られており、先天的にTREX1の機能が喪失することで、細胞質内に自己由来のDNAが異常に蓄積し、子宮内感染症と似た症状を示すことがわかっています。がん細胞においてTREX1の機能を不活性化させると、細胞質内へのDNAの蓄積およびSTING経路の活性化に伴い、がん細胞自身から免疫細胞の遊走/活性化に関わる様々な因子が分泌されることを明らかにしました。(図2)。また、マウスモデルにおいて、がん細胞のTREX1を不活性化すると、実際に免疫細胞ががん領域へ集積する様子が観察され、免疫チェックポイント阻害薬やSTING作動薬の治療効果も亢進することを明らかにしました(図3)。さらに、ヒトサンプルを対象としたデータベース解析において、TREX1は正常組織と比較して多くのがん組織において発現が高いことを明らかにしました。
[展開]
がん細胞は抗腫瘍免疫応答から回避するためにTREX1を利用することが明らかになりました。そのため、TREX1の不活性化はがん細胞の免疫原性を亢進させ、免疫チェックポイント阻害薬やSTING作動薬、免疫細胞療法などの奏功を改善するための新規治療法として有望であると考えられます。
(本研究への支援)
・日本学術振興会(JSPS)卓越研究員事業
・日本学術振興会(JSPS)科学研究費基盤(B)(20H03521、23H02753)(代表:北嶋俊輔)
(用語解説)
※1 Monopolar Spindle 1(MPS1)
細胞分裂時の染色体分配において染色体と微小管との結合が適切に行われることを監視する主要な制御因子の1つです。MPS1の阻害により、正常に染色体と微小管が結合する前に細胞分裂が進行してしまうため、染色体の構造が不安定になります。
※2 Negative Feedback経路
一般的にシグナルの安定性を促進するために、活性化したシグナルに対して抑制的に作用するブレーキの役割を担います。
※3 エカルディ・グティエール症候群(AGS) 経胎盤ウイルス感染症と酷似した早発性の小児炎症性疾患で、一般的には神経系に重度の影響が生じます。7種類の原因遺伝子が知られており、いずれもDNAおよびRNAの分解/編集に関わるタンパク質をコードしています。これらの遺伝子の先天性異常により、細胞質内に自己由来核酸の異常な蓄積が起こり、無菌性炎症を起こすと考えられています。
(論文情報)
論文名:TREX1 inactivation unleashes cancer cell STING-interferon signaling and promotes anti-tumor immunity
著者:Tetsuo Tani, Haritha Mathsyaraja, Marco Campisi, Ze-Hua Li, Koji Haratani, Caroline G. Fahey, Keiichi Ota, Navin R. Mahadevan, Yingxiao Shi, Shin Saito, Kei Mizuno, Tran C. Thai, Nobunari Sasaki, Mizuki Homme, Choudhury Fabliha B. Yusuf, Adam Kashishian, Jipsa Panchal, Min Wang, Benjamin Wolf, Thanh U. Barbie, Cloud P. Paweletz, Prafulla C Gokhale, David Liu, Ravindra Uppaluri, Shunsuke Kitajima*, Jennifer Cain*, and David A. Barbie*(*責任著者)
掲載誌:Cancer Discovery, doi:10.1158/2159-8290.CD-23-0700
●DNA分解酵素の1種であるThree Prime Repair Exonuclease 1(TREX1)の機能を不活性化することで、細胞質内にDNAが異常に蓄積し、DNAウイルス感染時に似た免疫反応が誘導される。
●マウスモデルにおいて、がん細胞のTREX1を不活性化すると、細胞傷害性T細胞などの免疫細胞ががん領域へ集積し、免疫チェックポイント阻害薬およびSTING作動薬の治療効果が増す。
●ヒトサンプルにおいて、TREX1は正常組織と比較して多くのがん組織において発現が高く、がん細胞特異的な治療標的となる可能性がある。
(概要説明)
公益財団法人がん研究会 がん研究所 細胞生物部の北嶋俊輔研究員(日本学術振興会 卓越研究員)を中心とする研究グループは、米国ダナファーバーがん研究所David A.Barbie博士らの研究グループおよび米国Gilead Sciences社との共同研究により、がん細胞において、細胞質内のDNAを認識し抗ウイルス/抗腫瘍免疫を誘導する「STING経路」が活性化することに伴い、細胞質内のDNA分解酵素の1種であるThree Prime Repair Exonuclease 1(TREX1)が増加することを明らかにしました。また、TREX1を不活性化させることで、がん細胞の細胞質内にDNAが蓄積し、がん細胞自身から免疫細胞の遊走/活性化に関わる因子が分泌されることを明らかにしました。さらに、複数のマウスモデルにおいて、がん細胞のTREX1を不活性化すると、免疫チェックポイント阻害薬およびSTING作動薬の治療効果が増すことを明らかにしました。本研究の成果は、米国学術誌「Cancer Discovery」(オンライン版)に2024年1月10日(現地時間)に公開されました。
(説明)
[背景]
国内では2015年に非小細胞肺がんに対して免疫チェックポイント阻害薬(ICI)が保険適応となり、一部の進行期肺がん患者にとって、非常に有効性が高い画期的な治療法となっています。一方で、ICIが有効な症例は2-3割にとどまり、ICI治療の有効性向上および抵抗性克服は喫緊の課題となっています。私たちは、これまでにがん細胞が免疫細胞から逃れるためのメカニズムの1つとして、DNAウイルス感染に対する自然免疫応答で主要な役割を果たす「STING経路(図1)」が、がん細胞内において不活性化されていることを報告してきました。そのため、がん細胞で不活性化されているSTING経路を効率的に再活性化することが出来れば、ICI抵抗性を克服するための良い治療戦略となる可能性があります。
[研究の内容と成果]
STING経路の活性化を誘導する新たな治療標的を探索するため、本研究では、STING経路に対する内因性の阻害(Negative Feedback)経路に着目しました。まず初めに、これまでにSTING経路を活性化する薬剤としてすでに見出していたMonopolar Spindle 1(MPS1)阻害薬を用いて、STING経路を活性化させました。次に、網羅的な遺伝子発現解析により、STING経路の活性化に伴い遺伝子発現が上昇するNegative Feedback因子候補を抽出しました。その結果、がん細胞において、STING経路が活性化することに伴い、細胞質内のDNA分解酵素の1種であるThree Prime Repair Exonuclease 1(TREX1)の遺伝子発現が上昇することを明らかにしました。TREX1は、自己免疫疾患エカルディ・グティエール症候群(AGS)の原因遺伝子としても知られており、先天的にTREX1の機能が喪失することで、細胞質内に自己由来のDNAが異常に蓄積し、子宮内感染症と似た症状を示すことがわかっています。がん細胞においてTREX1の機能を不活性化させると、細胞質内へのDNAの蓄積およびSTING経路の活性化に伴い、がん細胞自身から免疫細胞の遊走/活性化に関わる様々な因子が分泌されることを明らかにしました。(図2)。また、マウスモデルにおいて、がん細胞のTREX1を不活性化すると、実際に免疫細胞ががん領域へ集積する様子が観察され、免疫チェックポイント阻害薬やSTING作動薬の治療効果も亢進することを明らかにしました(図3)。さらに、ヒトサンプルを対象としたデータベース解析において、TREX1は正常組織と比較して多くのがん組織において発現が高いことを明らかにしました。
[展開]
がん細胞は抗腫瘍免疫応答から回避するためにTREX1を利用することが明らかになりました。そのため、TREX1の不活性化はがん細胞の免疫原性を亢進させ、免疫チェックポイント阻害薬やSTING作動薬、免疫細胞療法などの奏功を改善するための新規治療法として有望であると考えられます。

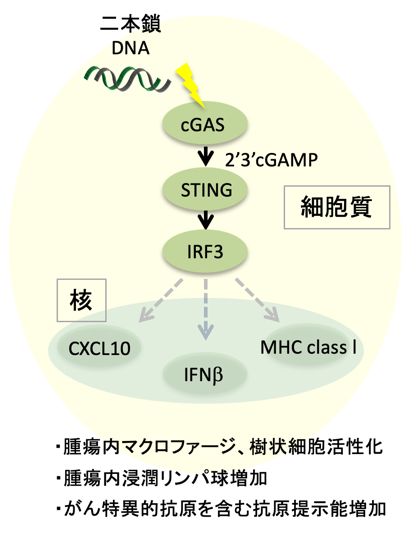
図1. STING経路によるがん細胞の免疫原性亢進メカニズム
細胞質内に蓄積した二本鎖DNAをcGASが認識して、STINGに結合し活性化するシグナル伝達分子である2’3’cGAMPを産生します。活性化したSTINGは転写因子IRF3を介して様々な抗腫瘍免疫関連因子の遺伝子発現を誘導します。

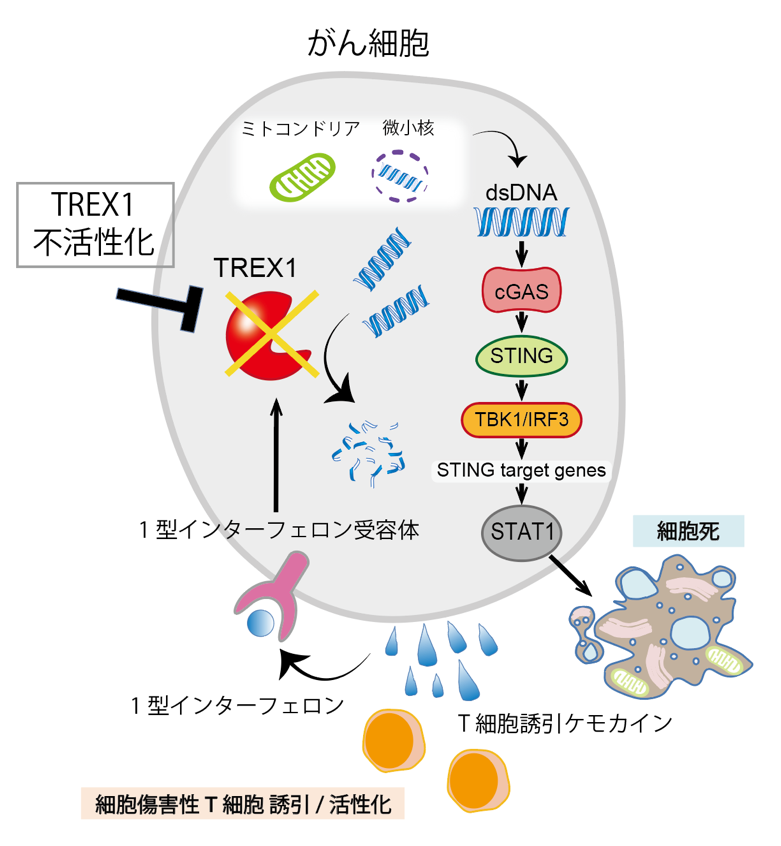
図2. TREX1不活性化に伴うSTING経路依存的なT細胞ケモカインや1型インターフェロンなどの分泌亢進
TREX1の不活性化により、細胞質内に二本鎖DNAが蓄積しやすくなることで、STING経路依存的に抗腫瘍免疫経路が活性化します。
TREX1の不活性化により、細胞質内に二本鎖DNAが蓄積しやすくなることで、STING経路依存的に抗腫瘍免疫経路が活性化します。

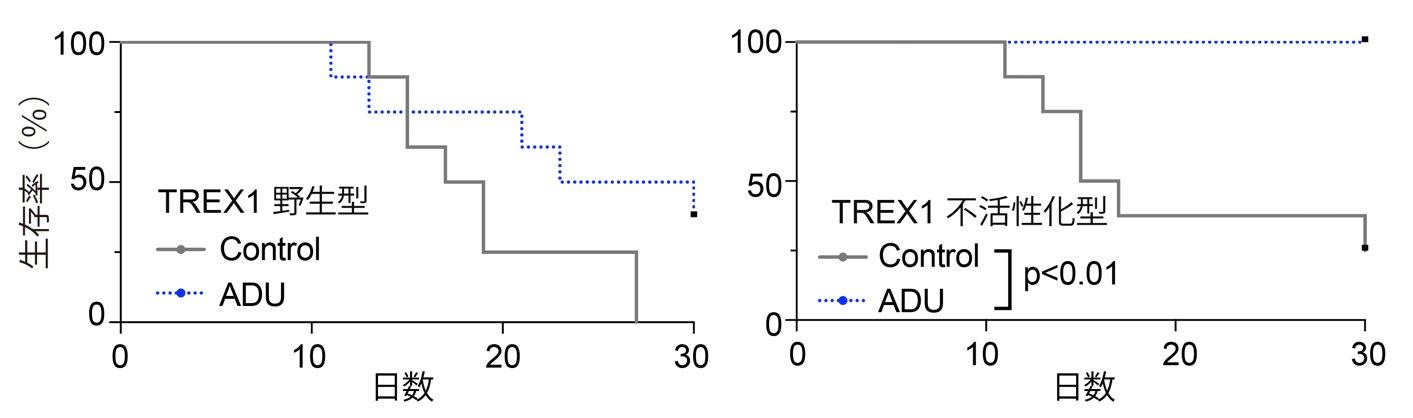
図3. TREX1不活性化に伴うSTIG作動薬ADU-S100の治療効果増強
B16F10メラノーマ細胞を用いてSTING作動薬の治療効果を検証した結果、特にTREX1不活性化細胞では治療に伴う有意な寿命延長が観察されました。
B16F10メラノーマ細胞を用いてSTING作動薬の治療効果を検証した結果、特にTREX1不活性化細胞では治療に伴う有意な寿命延長が観察されました。
(本研究への支援)
・日本学術振興会(JSPS)卓越研究員事業
・日本学術振興会(JSPS)科学研究費基盤(B)(20H03521、23H02753)(代表:北嶋俊輔)
(用語解説)
※1 Monopolar Spindle 1(MPS1)
細胞分裂時の染色体分配において染色体と微小管との結合が適切に行われることを監視する主要な制御因子の1つです。MPS1の阻害により、正常に染色体と微小管が結合する前に細胞分裂が進行してしまうため、染色体の構造が不安定になります。
※2 Negative Feedback経路
一般的にシグナルの安定性を促進するために、活性化したシグナルに対して抑制的に作用するブレーキの役割を担います。
※3 エカルディ・グティエール症候群(AGS) 経胎盤ウイルス感染症と酷似した早発性の小児炎症性疾患で、一般的には神経系に重度の影響が生じます。7種類の原因遺伝子が知られており、いずれもDNAおよびRNAの分解/編集に関わるタンパク質をコードしています。これらの遺伝子の先天性異常により、細胞質内に自己由来核酸の異常な蓄積が起こり、無菌性炎症を起こすと考えられています。
(論文情報)
論文名:TREX1 inactivation unleashes cancer cell STING-interferon signaling and promotes anti-tumor immunity
著者:Tetsuo Tani, Haritha Mathsyaraja, Marco Campisi, Ze-Hua Li, Koji Haratani, Caroline G. Fahey, Keiichi Ota, Navin R. Mahadevan, Yingxiao Shi, Shin Saito, Kei Mizuno, Tran C. Thai, Nobunari Sasaki, Mizuki Homme, Choudhury Fabliha B. Yusuf, Adam Kashishian, Jipsa Panchal, Min Wang, Benjamin Wolf, Thanh U. Barbie, Cloud P. Paweletz, Prafulla C Gokhale, David Liu, Ravindra Uppaluri, Shunsuke Kitajima*, Jennifer Cain*, and David A. Barbie*(*責任著者)
掲載誌:Cancer Discovery, doi:10.1158/2159-8290.CD-23-0700
関連PDF
- ニュースリリース文書
 (488.9KB )
(488.9KB )