【ニュースリリース】EGFR遺伝子変異陽性肺がんに対する薬剤耐性克服薬候補の発見 〜第4世代EGFR阻害薬による治療戦略の可能性〜
2024年02月26日
1.ポイント
・オシメルチニブ耐性のEGFR変異(EGFR-T790M+C797S)肺がん細胞にブリグチニブと抗EGFR抗体との併用療法が有用である可能性を動物実験で確認しました。
・共結晶構造解析により、ブリグチニブがEGFR-T790M+C797S変異体に直接結合する様子を詳細に明らかにしました。
・変異原物質(ENU)によって人工的に変異を誘発しブリグチニブに耐性となる変異体を複数発見し、それらが既存のEGFR阻害薬に耐性を示すことを見出しました。
・ブリグチニブ耐性を示すEGFR-T790M+C797S+L718M変異体は大環状構造をもつ第4世代EGFR阻害薬のBI-4020やBLU-945に感受性を示すことを見出しました。
・スーパーコンピュータ「富岳」を用いた分子動力学シミュレーションにより、BI-4020がEGFR変異体に結合する様子や結合親和性の理解が可能になりました。
2.研究の概要
日本人のがんによる死因の第1位である肺がんのうち、約85%は非小細胞肺がんに分類されます。わが国ではEGFR活性化変異(注1)は、非小細胞肺がんの約30〜40%に認められ、EGFR阻害薬が高い抗腫瘍効果を示しています。これまでに5種類のEGFR阻害薬(注2)が承認され臨床応用されていますが、数年以内に耐性化し、腫瘍が再増悪してしまいます。特にEGFR活性化変異にT790MとC797S変異が加わる(以下EGFR-T790M+C797S)と、既存のあらゆるEGFR阻害薬に耐性を示すことが課題となっています。我々は以前、ALK阻害薬として臨床応用されているブリグチニブ(アルンブリグ®)と抗EGFR抗体との併用療法がこのEGFR-T790M+C797S変異にも有効であることを発見し発表しました(Uchibori K et al, Nature Commun 2017)。この結果に基づき、ブリグチニブと抗EGFR抗体の併用臨床試験が計画されました。
この研究では、我々はこのブリグチニブ併用療法に対しても新たな耐性変異の出現が予想されると考え、耐性機構の探索と克服法の発見を目標に研究を進めました。がん研究会の片山量平(がん研究会 がん化学療法センター 基礎研究部 部長)、内堀健(がん研究会 がん研有明病院 呼吸器内科 医長)、鈴木麻衣(東京大学大学院 新領域創成科学研究科 大学院博士課程(当時))らの研究グループは、はじめにブリグチニブと様々な抗EGFR抗体との併用療法を行うことで、その有用性を動物実験により検証しました。次に、理化学研究所 白水美香子博士らとの共同研究から、結晶構造解析によりブリグチニブがEGFR-T790M+C797S変異体にどのように結合し阻害しているか、結合に重要なアミノ酸残基はどれかを明らかにしました。さらに、N-エチル-N-ニトロソウレア(ENU)変異誘発スクリーニングにより、ブリグチニブ耐性変異を予測し、臨床的にオシメルチニブ耐性変異としても報告されているL718およびG796変異がEGFR-T790M+C797Sに新たに加わることでブリグチニブ耐性を誘導することを見出しました。この同定したEGFR活性化変異+T790M+C797S+L718M変異体は、臨床承認されたすべてのEGFR阻害薬に対して耐性を示し、大環状構造を持つ第4世代のEGFR阻害剤BI-4020により克服できる可能性が示されました。一方で、BI-4020はEGFR-L747Pや-S768Iのような低頻度で見つかる活性化変異体には阻害活性を示さないことが明らかになりました。また、京都大学 奥野恭史教授らとの共同研究により、スーパーコンピュータ「富岳」を用いた分子動力学シミュレーションが行われ、BI-4020とEGFR変異体の結合様式の推定やその結合親和性を計算科学から明らかにしました。
本研究は、これから出現してくるかもしれない“究極の耐性変異体”を克服するための手法として、大環状構造を持つ第4世代EGFR阻害薬BI-4020を用いた治療戦略の可能性を明らかにしました。
本研究の成果は、Nature Publishing Group のパートナー誌である npj Precision Oncology に、2024年2月23日に公開されました。
3.論文名、著者およびその所属
○論文名
A macrocyclic kinase inhibitor overcomes triple resistant mutations in EGFR-positive lung cancer
○ジャーナル名
npj Precision Oncology(Nature Publishing Groupのパートナー誌)
○著者
Mai Suzuki1,2,*, Ken Uchibori1,3*, Tomoko Oh-hara1, Yumi Nomura1, Ryusei Suzuki1, Ai Takemoto1, Mitsugu Araki4, Shigeyuki Matsumoto4, Yukari Sagae4, Mutsuko Kukimoto-Niino5, Yusuke Kawase6, Mikako Shirouzu5, Yasushi Okuno4, Makoto Nishio3, Naoya Fujita7, Ryohei Katayama1,2†
(* 筆頭著者、† 責任著者)
○著者の所属機関
1.公益財団法人がん研究会 がん化学療法センター 基礎研究部
2.東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻
3.公益財団法人がん研究会 がん研有明病院 呼吸器内科
4.京都大学大学院 医学研究科
5.理化学研究所 生命機能科学研究センター
6.カルナバイオサイエンス株式会社
7.公益財団法人がん研究会 がん化学療法センター
4.研究の詳細
背景と経緯
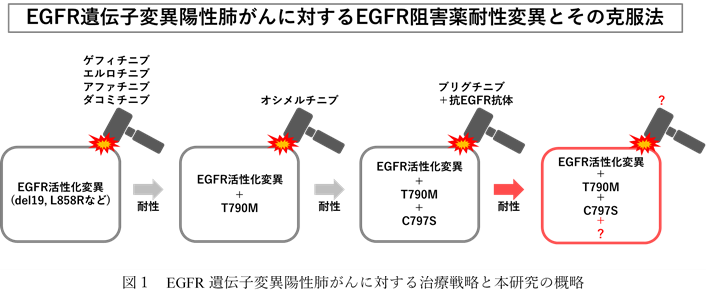
我が国の非小細胞肺がんの30〜40%では、EGFR活性化変異が認められています。このうち約90%の患者さんでは、EGFRの活性を担うキナーゼ領域内にdel19変異か、L858R変異を有しています。また、残りの約10%の患者さんではexon20挿入変異やG719X、L747P、S768Iといった変異が低頻度に見つかることが知られています。これらの変異はリガンド非依存的にEGFRを恒常的に活性化し、がん化の原因となっているため、分子標的薬であるEGFR阻害薬が高い抗腫瘍効果を示します。これまでに、第1世代のゲフィチニブ(イレッサ®)、エルロチニブ(タルセバ®)、第2世代のアファチニブ(ジオトリフ®)、ダコミチニブ(ビジンプロ®)が第1選択薬として使用されてきました。しかしながら、数年以内に50〜70%の患者さんではT790M変異が出現することで耐性化してしまいます。第3世代のオシメルチニブ(タグリッソ®)はT790M耐性変異の克服薬として開発され、高い奏効率を示しました。さらに、初回治療からオシメルチニブを使用しても持続的で高い抗腫瘍効果が認められたことから、現在では初回治療の第1選択薬としても使用されています。しかしながらオシメルチニブ治療後の約10〜20%の患者さんでは、C797S耐性変異が出現し、数年以内に再発してしまう方が少なくありません。特に第1、2世代EGFR阻害薬耐性時にT790M変異が出現しオシメルチニブ治療を行った際などに認められるEGFR-T790M+C797S重複変異は、既存のあらゆるEGFR阻害薬に耐性を示すことが課題となっていました。我々は以前ALK阻害薬として臨床応用されているブリグチニブと、抗EGFR抗体との併用療法がこのEGFR-T790M+C797S変異にも有効であることを見出しました(Uchibori K et al, Nature Commun 2017)。この結果に基づき、ブリグチニブと抗EGFR抗体の併用臨床試験が、オシメルチニブ耐性のEGFR-C797S変異陽性患者を対象に開始されました。しかしながら、このブリグチニブ併用療法に対しても耐性変異が出現する可能性が懸念されます(図1)。
研究内容
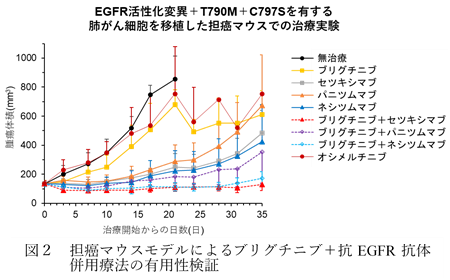
まず、ブリグチニブと抗EGFR抗体の併用療法の有用性を検証するため、ブリグチニブと様々な抗EGFR抗体(セツキシマブ:アービタックス®、パニツムマブ:ベクティビックス®、ネシツムマブ:ポートラーザ®)との併用療法を、遺伝子導入によりEGFR活性化変異+C797S およびEGFR活性化変異+T790M+C797Sを有する肺がん細胞株を用いて検討しました。また、これらの耐性変異を導入したがん細胞をマウス皮下に移植して作製した担癌マウスモデルを使用し動物実験を行いました。その結果、細胞株および動物実験ともに、ブリグチニブといずれの抗EGFR抗体併用療法においても高い抗腫瘍効果を示すことが明らかになりました(図2)。
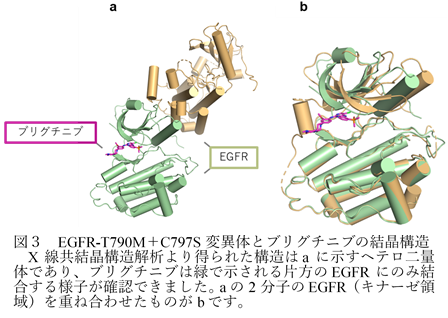
 次に、理化学研究所の白水美香子博士らとの共同研究により、ブリグチニブがEGFR-T790M+C797S変異体にどのように結合しているのかを明らかにするため、結晶構造解析を行いました。その結果、ブリグチニブはEGFR-T790M+C797S変異体のヘテロ二量体のうちの片方のEGFRにのみ結合することが明らかになりました(図3)。また、ブリグチニブはL718やL792、F723といったアミノ酸残基との相互作用により強固に結合しており、ブリグチニブの結合に寄与するアミノ酸残基を同定しました。
次に、理化学研究所の白水美香子博士らとの共同研究により、ブリグチニブがEGFR-T790M+C797S変異体にどのように結合しているのかを明らかにするため、結晶構造解析を行いました。その結果、ブリグチニブはEGFR-T790M+C797S変異体のヘテロ二量体のうちの片方のEGFRにのみ結合することが明らかになりました(図3)。また、ブリグチニブはL718やL792、F723といったアミノ酸残基との相互作用により強固に結合しており、ブリグチニブの結合に寄与するアミノ酸残基を同定しました。
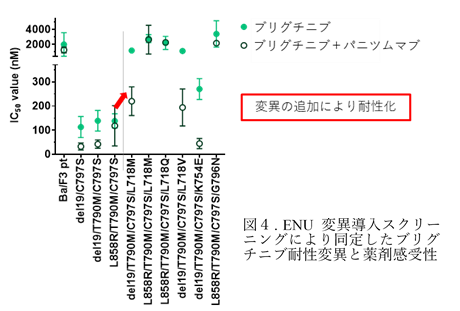
 次に、ブリグチニブ併用療法に耐性となる変異を予測するために、IL-3依存的に増殖するマウス前駆Bリンパ球(Ba/F3細胞株)に、EGFR活性化変異+T790M+C797Sを、遺伝子導入し、IL-3を培地中に添加しなくてもEGFRに依存して増殖できるBa/F3細胞を樹立し、N-エチル-N-ニトロソウレア(ENU)変異誘発スクリーニングを行いました。その結果、臨床的にもオシメルチニブ耐性変異として報告されているL718およびG796変異などがEGFR活性化変異+T790M+C797S重複変異に追加で加わることでブリグチニブ耐性を誘導することが明らかになりました(図4)。この同定したEGFR活性化変異+T790M+C797S+L718M変異体は、臨床承認されているあらゆる既存のEGFR阻害薬に対して耐性であることが明らかになりました。
次に、ブリグチニブ併用療法に耐性となる変異を予測するために、IL-3依存的に増殖するマウス前駆Bリンパ球(Ba/F3細胞株)に、EGFR活性化変異+T790M+C797Sを、遺伝子導入し、IL-3を培地中に添加しなくてもEGFRに依存して増殖できるBa/F3細胞を樹立し、N-エチル-N-ニトロソウレア(ENU)変異誘発スクリーニングを行いました。その結果、臨床的にもオシメルチニブ耐性変異として報告されているL718およびG796変異などがEGFR活性化変異+T790M+C797S重複変異に追加で加わることでブリグチニブ耐性を誘導することが明らかになりました(図4)。この同定したEGFR活性化変異+T790M+C797S+L718M変異体は、臨床承認されているあらゆる既存のEGFR阻害薬に対して耐性であることが明らかになりました。
この耐性変異体を克服できる薬剤を探索するため、EGFR阻害薬を中心とした阻害剤スクリーニングをEGFR活性化変異+T790M+C797S+L718M変異体を発現させたBa/F3細胞を用いて行いました。その結果、大環状構造を持つ第4世代のEGFR阻害薬であるBI-4020に高感受性を示すことが明らかになり、さらに抗EGFR抗体を併用することでその阻害活性が増強されることを見出しました(図5)。この結果は動物実験でも検証され、BI-4020と抗EGFR抗体併用療法によって高い抗腫瘍効果が得られました。BI-4020はEGFR活性化変異+T790M+C797S+L718M変異体だけでなく、del19やL858RなどのEGFR活性化変異体やEGFR活性化変異+C797S変異体、EGFR活性化変異+T790M+C797S変異体発現細胞に対しても高い阻害活性を示す一方、低頻度で見つかるEGFR活性化変異の1つ、EGFR-L747Pには十分な阻害活性を示さないことが明らかになりました。
 BI-4020のEGFR変異体発現細胞の増殖阻害活性が直接EGFRを阻害したことによるかを検証するために、カルナバイオ社との共同研究により、EGFR耐性重複変異体の精製キナーゼを合成していただき、in vitroキナーゼアッセイによりその阻害活性を検証しました。その結果、BI-4020はわずか数nMの低濃度で重複耐性変異型EGFRを阻害できる一方で、L747PやS768I活性化変異体の阻害には数百nMの濃度が必要でした。
BI-4020のEGFR変異体発現細胞の増殖阻害活性が直接EGFRを阻害したことによるかを検証するために、カルナバイオ社との共同研究により、EGFR耐性重複変異体の精製キナーゼを合成していただき、in vitroキナーゼアッセイによりその阻害活性を検証しました。その結果、BI-4020はわずか数nMの低濃度で重複耐性変異型EGFRを阻害できる一方で、L747PやS768I活性化変異体の阻害には数百nMの濃度が必要でした。
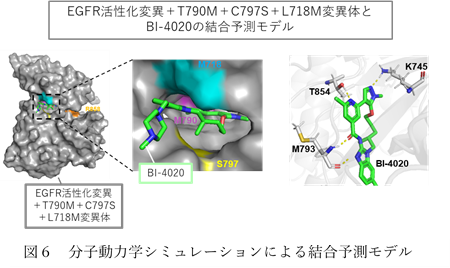
さらに、京都大学の奥野恭史博士らとの共同研究により、スーパーコンピュータ「富岳」を用いた分子動力学シミュレーションを行うことで、BI-4020がEGFR変異体にどのように結合しているのかを推定しました。その結果、BI-4020の結合様式の詳細と、結合に重要なEGFRタンパク内のアミノ酸残基の推定に成功しました(図6)。
 本研究により、これから出現してくるかもしれない“究極の耐性変異体”を克服するための手法として、大環状構造を持つEGFR阻害剤BI-4020を用いた治療戦略の可能性が示されました。
本研究により、これから出現してくるかもしれない“究極の耐性変異体”を克服するための手法として、大環状構造を持つEGFR阻害剤BI-4020を用いた治療戦略の可能性が示されました。
5.本研究への支援
本研究は、下記機関より資金的支援等を受けて実施されました。
・国立研究開発法人日本医療研究開発機構(AMED) 次世代がん医療創生研究事業(P-CREATE)、次世代がん医療加速化研究事業(P-PROMOTE)
・独立行政法人日本学術振興会 科学研究費補助金
・公益財団法人 高松宮妃癌研究基金
・公益財団法人 細胞科学研究財団
・公益財団法人 中外創薬科学財団
・公益財団法人 武田科学振興財団
・日本財団
・公益財団法人 計算科学振興財団(FOCUS)
・文部科学省 「富岳」成果創出加速プログラム 「プレシジョンメディスンを加速する創薬ビッグデータ統合システムの推進」
・文部科学省 「富岳」成果創出加速プログラム 「富岳」で目指すシミュレーション・AI駆動型次世代医療・創薬(JPMXP1020230120) (課題責任者 奥野恭史 教授)
・本論文の一部は、理化学研究所のスーパーコンピュータ「富岳」を利用して得られたものです。(課題番号: hp220164)
6.用語解説
(注1)EGFR活性化変異
EGFR(epidermal growth factor receptor:上皮成長因子受容体)は細胞表面上に発現するタンパク質で、受容体型チロシンキナーゼの1つです。正常時では、細胞外領域にEGF(上皮成長因子)などのリガンドが結合することでEGFRが二量体を形成して活性化し、細胞の成長や増殖促進に寄与しています。EGFR活性化変異は、外部からのシグナルを受けずにEGFRを恒常的に活性化させる遺伝子変異で、その約9割をdel19(exon19の約5アミノ酸欠損変異)とL858R変異が占めています。
(注2)EGFR阻害薬
EGFRを標的とした分子標的薬であり、現在日本ではゲフィチニブ、エルロチニブ、アファチニブ、ダコミチニブ、オシメルチニブの5剤が承認されています。
・オシメルチニブ耐性のEGFR変異(EGFR-T790M+C797S)肺がん細胞にブリグチニブと抗EGFR抗体との併用療法が有用である可能性を動物実験で確認しました。
・共結晶構造解析により、ブリグチニブがEGFR-T790M+C797S変異体に直接結合する様子を詳細に明らかにしました。
・変異原物質(ENU)によって人工的に変異を誘発しブリグチニブに耐性となる変異体を複数発見し、それらが既存のEGFR阻害薬に耐性を示すことを見出しました。
・ブリグチニブ耐性を示すEGFR-T790M+C797S+L718M変異体は大環状構造をもつ第4世代EGFR阻害薬のBI-4020やBLU-945に感受性を示すことを見出しました。
・スーパーコンピュータ「富岳」を用いた分子動力学シミュレーションにより、BI-4020がEGFR変異体に結合する様子や結合親和性の理解が可能になりました。
2.研究の概要
日本人のがんによる死因の第1位である肺がんのうち、約85%は非小細胞肺がんに分類されます。わが国ではEGFR活性化変異(注1)は、非小細胞肺がんの約30〜40%に認められ、EGFR阻害薬が高い抗腫瘍効果を示しています。これまでに5種類のEGFR阻害薬(注2)が承認され臨床応用されていますが、数年以内に耐性化し、腫瘍が再増悪してしまいます。特にEGFR活性化変異にT790MとC797S変異が加わる(以下EGFR-T790M+C797S)と、既存のあらゆるEGFR阻害薬に耐性を示すことが課題となっています。我々は以前、ALK阻害薬として臨床応用されているブリグチニブ(アルンブリグ®)と抗EGFR抗体との併用療法がこのEGFR-T790M+C797S変異にも有効であることを発見し発表しました(Uchibori K et al, Nature Commun 2017)。この結果に基づき、ブリグチニブと抗EGFR抗体の併用臨床試験が計画されました。
この研究では、我々はこのブリグチニブ併用療法に対しても新たな耐性変異の出現が予想されると考え、耐性機構の探索と克服法の発見を目標に研究を進めました。がん研究会の片山量平(がん研究会 がん化学療法センター 基礎研究部 部長)、内堀健(がん研究会 がん研有明病院 呼吸器内科 医長)、鈴木麻衣(東京大学大学院 新領域創成科学研究科 大学院博士課程(当時))らの研究グループは、はじめにブリグチニブと様々な抗EGFR抗体との併用療法を行うことで、その有用性を動物実験により検証しました。次に、理化学研究所 白水美香子博士らとの共同研究から、結晶構造解析によりブリグチニブがEGFR-T790M+C797S変異体にどのように結合し阻害しているか、結合に重要なアミノ酸残基はどれかを明らかにしました。さらに、N-エチル-N-ニトロソウレア(ENU)変異誘発スクリーニングにより、ブリグチニブ耐性変異を予測し、臨床的にオシメルチニブ耐性変異としても報告されているL718およびG796変異がEGFR-T790M+C797Sに新たに加わることでブリグチニブ耐性を誘導することを見出しました。この同定したEGFR活性化変異+T790M+C797S+L718M変異体は、臨床承認されたすべてのEGFR阻害薬に対して耐性を示し、大環状構造を持つ第4世代のEGFR阻害剤BI-4020により克服できる可能性が示されました。一方で、BI-4020はEGFR-L747Pや-S768Iのような低頻度で見つかる活性化変異体には阻害活性を示さないことが明らかになりました。また、京都大学 奥野恭史教授らとの共同研究により、スーパーコンピュータ「富岳」を用いた分子動力学シミュレーションが行われ、BI-4020とEGFR変異体の結合様式の推定やその結合親和性を計算科学から明らかにしました。
本研究は、これから出現してくるかもしれない“究極の耐性変異体”を克服するための手法として、大環状構造を持つ第4世代EGFR阻害薬BI-4020を用いた治療戦略の可能性を明らかにしました。
本研究の成果は、Nature Publishing Group のパートナー誌である npj Precision Oncology に、2024年2月23日に公開されました。
3.論文名、著者およびその所属
○論文名
A macrocyclic kinase inhibitor overcomes triple resistant mutations in EGFR-positive lung cancer
○ジャーナル名
npj Precision Oncology(Nature Publishing Groupのパートナー誌)
○著者
Mai Suzuki1,2,*, Ken Uchibori1,3*, Tomoko Oh-hara1, Yumi Nomura1, Ryusei Suzuki1, Ai Takemoto1, Mitsugu Araki4, Shigeyuki Matsumoto4, Yukari Sagae4, Mutsuko Kukimoto-Niino5, Yusuke Kawase6, Mikako Shirouzu5, Yasushi Okuno4, Makoto Nishio3, Naoya Fujita7, Ryohei Katayama1,2†
(* 筆頭著者、† 責任著者)
○著者の所属機関
1.公益財団法人がん研究会 がん化学療法センター 基礎研究部
2.東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻
3.公益財団法人がん研究会 がん研有明病院 呼吸器内科
4.京都大学大学院 医学研究科
5.理化学研究所 生命機能科学研究センター
6.カルナバイオサイエンス株式会社
7.公益財団法人がん研究会 がん化学療法センター
4.研究の詳細
背景と経緯
我が国の非小細胞肺がんの30〜40%では、EGFR活性化変異が認められています。このうち約90%の患者さんでは、EGFRの活性を担うキナーゼ領域内にdel19変異か、L858R変異を有しています。また、残りの約10%の患者さんではexon20挿入変異やG719X、L747P、S768Iといった変異が低頻度に見つかることが知られています。これらの変異はリガンド非依存的にEGFRを恒常的に活性化し、がん化の原因となっているため、分子標的薬であるEGFR阻害薬が高い抗腫瘍効果を示します。これまでに、第1世代のゲフィチニブ(イレッサ®)、エルロチニブ(タルセバ®)、第2世代のアファチニブ(ジオトリフ®)、ダコミチニブ(ビジンプロ®)が第1選択薬として使用されてきました。しかしながら、数年以内に50〜70%の患者さんではT790M変異が出現することで耐性化してしまいます。第3世代のオシメルチニブ(タグリッソ®)はT790M耐性変異の克服薬として開発され、高い奏効率を示しました。さらに、初回治療からオシメルチニブを使用しても持続的で高い抗腫瘍効果が認められたことから、現在では初回治療の第1選択薬としても使用されています。しかしながらオシメルチニブ治療後の約10〜20%の患者さんでは、C797S耐性変異が出現し、数年以内に再発してしまう方が少なくありません。特に第1、2世代EGFR阻害薬耐性時にT790M変異が出現しオシメルチニブ治療を行った際などに認められるEGFR-T790M+C797S重複変異は、既存のあらゆるEGFR阻害薬に耐性を示すことが課題となっていました。我々は以前ALK阻害薬として臨床応用されているブリグチニブと、抗EGFR抗体との併用療法がこのEGFR-T790M+C797S変異にも有効であることを見出しました(Uchibori K et al, Nature Commun 2017)。この結果に基づき、ブリグチニブと抗EGFR抗体の併用臨床試験が、オシメルチニブ耐性のEGFR-C797S変異陽性患者を対象に開始されました。しかしながら、このブリグチニブ併用療法に対しても耐性変異が出現する可能性が懸念されます(図1)。
研究内容
まず、ブリグチニブと抗EGFR抗体の併用療法の有用性を検証するため、ブリグチニブと様々な抗EGFR抗体(セツキシマブ:アービタックス®、パニツムマブ:ベクティビックス®、ネシツムマブ:ポートラーザ®)との併用療法を、遺伝子導入によりEGFR活性化変異+C797S およびEGFR活性化変異+T790M+C797Sを有する肺がん細胞株を用いて検討しました。また、これらの耐性変異を導入したがん細胞をマウス皮下に移植して作製した担癌マウスモデルを使用し動物実験を行いました。その結果、細胞株および動物実験ともに、ブリグチニブといずれの抗EGFR抗体併用療法においても高い抗腫瘍効果を示すことが明らかになりました(図2)。



この耐性変異体を克服できる薬剤を探索するため、EGFR阻害薬を中心とした阻害剤スクリーニングをEGFR活性化変異+T790M+C797S+L718M変異体を発現させたBa/F3細胞を用いて行いました。その結果、大環状構造を持つ第4世代のEGFR阻害薬であるBI-4020に高感受性を示すことが明らかになり、さらに抗EGFR抗体を併用することでその阻害活性が増強されることを見出しました(図5)。この結果は動物実験でも検証され、BI-4020と抗EGFR抗体併用療法によって高い抗腫瘍効果が得られました。BI-4020はEGFR活性化変異+T790M+C797S+L718M変異体だけでなく、del19やL858RなどのEGFR活性化変異体やEGFR活性化変異+C797S変異体、EGFR活性化変異+T790M+C797S変異体発現細胞に対しても高い阻害活性を示す一方、低頻度で見つかるEGFR活性化変異の1つ、EGFR-L747Pには十分な阻害活性を示さないことが明らかになりました。

さらに、京都大学の奥野恭史博士らとの共同研究により、スーパーコンピュータ「富岳」を用いた分子動力学シミュレーションを行うことで、BI-4020がEGFR変異体にどのように結合しているのかを推定しました。その結果、BI-4020の結合様式の詳細と、結合に重要なEGFRタンパク内のアミノ酸残基の推定に成功しました(図6)。

5.本研究への支援
本研究は、下記機関より資金的支援等を受けて実施されました。
・国立研究開発法人日本医療研究開発機構(AMED) 次世代がん医療創生研究事業(P-CREATE)、次世代がん医療加速化研究事業(P-PROMOTE)
・独立行政法人日本学術振興会 科学研究費補助金
・公益財団法人 高松宮妃癌研究基金
・公益財団法人 細胞科学研究財団
・公益財団法人 中外創薬科学財団
・公益財団法人 武田科学振興財団
・日本財団
・公益財団法人 計算科学振興財団(FOCUS)
・文部科学省 「富岳」成果創出加速プログラム 「プレシジョンメディスンを加速する創薬ビッグデータ統合システムの推進」
・文部科学省 「富岳」成果創出加速プログラム 「富岳」で目指すシミュレーション・AI駆動型次世代医療・創薬(JPMXP1020230120) (課題責任者 奥野恭史 教授)
・本論文の一部は、理化学研究所のスーパーコンピュータ「富岳」を利用して得られたものです。(課題番号: hp220164)
6.用語解説
(注1)EGFR活性化変異
EGFR(epidermal growth factor receptor:上皮成長因子受容体)は細胞表面上に発現するタンパク質で、受容体型チロシンキナーゼの1つです。正常時では、細胞外領域にEGF(上皮成長因子)などのリガンドが結合することでEGFRが二量体を形成して活性化し、細胞の成長や増殖促進に寄与しています。EGFR活性化変異は、外部からのシグナルを受けずにEGFRを恒常的に活性化させる遺伝子変異で、その約9割をdel19(exon19の約5アミノ酸欠損変異)とL858R変異が占めています。
(注2)EGFR阻害薬
EGFRを標的とした分子標的薬であり、現在日本ではゲフィチニブ、エルロチニブ、アファチニブ、ダコミチニブ、オシメルチニブの5剤が承認されています。
関連PDF
- ニュースリリース文書
 (1,208.5KB )
(1,208.5KB )