【ニュースリリース】ROS1融合遺伝子陽性肺がんに対する新薬候補化合物DS-6051bの共同研究成果 〜今後予想されるクリゾチニブ耐性の克服に向けて〜
2019年08月09日
1.概要
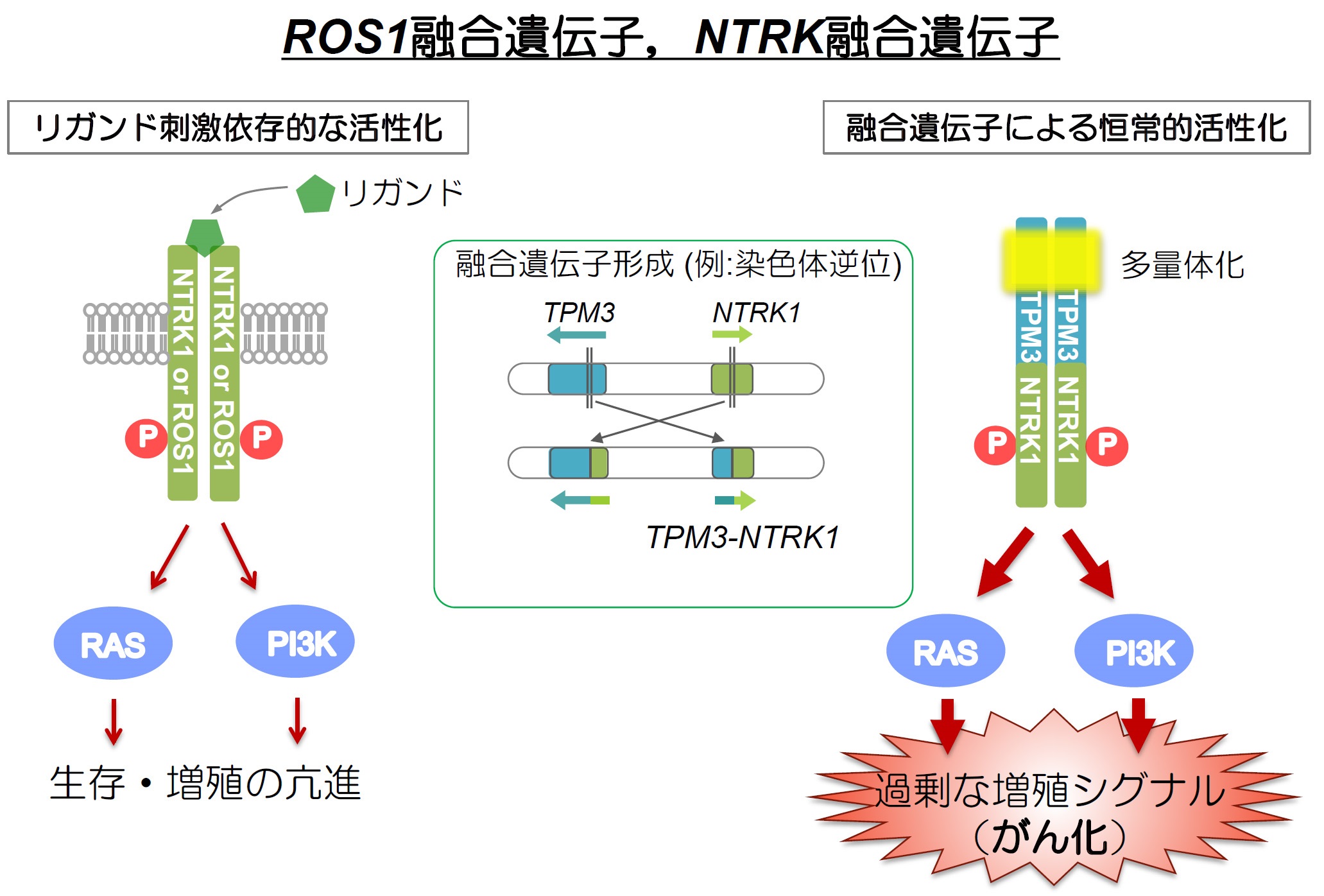
現在、我が国においてがんによる死因の1位は肺がんですが、その中で約1%程度の患者さんに、ROS1融合遺伝子(注1、下図)というがんを引き起こす遺伝子異常が見つかります。このタイプの進行肺がん患者さんには、現在、クリゾチニブ(ザーコリ®)とよばれる分子標的薬(ROS1の活性を阻害する薬剤)が承認されて臨床で高い有効性を示しております。しかし、ほとんどの症例において1年から数年以内にクリゾチニブへの耐性を獲得してがんが再発してしまうことが問題となっています。この耐性を引き起こすメカニズムの中で、最も高い頻度で認められているのが、ROS1融合遺伝子の変異(G2032Rなど(注3))によりクリゾチニブがROS1に結合しにくくなり阻害できなくなるというものであり、この耐性にも有効な薬剤はありませんでした。
がん研究会の片山量平らの研究グループと第一三共株式会社(以下「第一三共」)の共同研究において、第一三共が次世代ROS1/NTRK阻害薬として創製したDS-6051bが、ROS1チロシンキナーゼ(注4)とNTRKチロシンキナーゼ(注5)(NTRK1, NTRK2, およびNTRK3)を低濃度(数nMから十数nM)で阻害し、試験管内および動物実験において、腫瘍縮小効果を発揮することが示されました。また、DS-6051bはクリゾチニブへの高度耐性を示すROS1-G2032R耐性変異体にも有効であることも実験的に明らかにしました。
DS-6051bは本邦および米国を中心に、ROS1融合遺伝子陽性またはNTRK融合遺伝子陽性がんを対象に臨床試験が行われており(*2018年12月に第一三共はAnheart Therapeutics社に、DS-6051の全世界での開発、製造および販売権を供与しています)、本研究の結果は、ROS1融合遺伝子陽性またはNTRK融合遺伝子陽性肺がんの将来的な治療開発に貢献しうる成果であると考えられます。
本研究の成果は、Nature Publishing Groupオープンアクセス誌Nature Communicationsに、2019年8月9日付で公開されました。
2.ポイント
●非小細胞肺がんの約1%にROS1融合遺伝子が見つかり、ROS1阻害薬クリゾチニブが臨床応用されていますがG2032R変異などによる耐性が問題となっており、有効な治療法は確立していません。
●新たに開発された新薬候補化合物DS-6051bはROS1およびNTRKチロシンキナーゼの選択的な阻害薬であり、クリゾチニブ耐性のG2032Rに対しても有効である可能性が実験的に示されました。
●DS-6501bは日本および米国を中心としてROS1およびNTRK融合遺伝子陽性がんを対象として臨床試験が行われていますが、今後実用化されるためには安全性と有効性を引き続き評価していく必要があります。
3.論文名、著者およびその所属
○論文名
The new-generation selective ROS1/NTRK Inhibitor DS-6051b overcomes crizotinib resistant ROS1-G2032R mutation in preclinical models.
○ジャーナル名
Nature Communications (Nature Publishing Groupのオープンアクセス誌)
(※2019年8月9日付でオンラインに掲載されました。)
○著者
Ryohei Katayama1*, Bo Gong1,2, Noriko Togashi3, Masaya Miyamoto3, Masaki Kiga3, Shiho Iwasaki3, Yasuki Kamai3, Yuichi Tominaga3, Yasuyuki Takeda3, Yoshiko Kagoshima3, Yuki Shimizu1,2, Yosuke Seto1, Tomoko Oh-hara1, Sumie Koike1, Naoki Nakao4, Hiroyuki Hanzawa4, Kengo Watanabe3, Satoshi Yoda5,6, Noriko Yanagitani7, Aaron N. Hata5,6, Alice T. Shaw5,6, Makoto Nishio7, Naoya Fujita1,2, Takeshi Isoyama3*
* 責任著者
○著者の所属機関
1. (公財)がん研究会 がん化学療法センター 基礎研究部
2. 東京大学大学院 新領域創成科学研究科
3. 第一三共株式会社
4. 第一三共RDノバーレ株式会社
5. マサチューセッツ総合病院 がんセンター
6. ハーバード大学 医学部
7. (公財)がん研究会 有明病院 呼吸器内科
4.研究の詳細
背景と経緯
肺がんにおいては、様々なチロシンキナーゼを異常に活性化する変異や融合遺伝子などの発がん性ドライバー遺伝子が同定されており、これらの遺伝子産物(異常活性化したチロシンキナーゼ)を標的とする多くのチロシンキナーゼ阻害剤(TKI)が開発されてきました。このドライバーがん遺伝子のうち、未分化リンパ腫キナーゼ(ALK)やROSがん原遺伝子(ROS1)、および神経成長因子受容体(NTRK)の融合遺伝子はそれぞれ肺がんの0.1%〜5%に観察されます。ROS1融合遺伝子は、非小細胞肺がん(NSCLC)以外にも、胆管がん、膠芽腫、卵巣がん、胃がん、および結腸直腸がんでも低頻度ながら発見されています。ROS1融合遺伝子陽性のNSCLCの治療薬として、様々なROS1阻害薬が開発されてきておりますが、中でもALK / ROS1 / MET阻害薬であるクリゾチニブは、臨床試験において、7割を超える患者に高い治療効果が認められ、わが国をはじめ複数の国で承認されています。実際の臨床においてもROS1融合遺伝子陽性NSCLCに対して、クリゾチニブはほとんどの症例で顕著な腫瘍縮小効果を認めますが、数年以内にクリゾチニブに対する耐性を獲得しがんが再発することが多くの症例で確認され、問題となっています。特に、ROS1チロシンキナーゼ領域内のG2032R変異は、クリゾチニブだけでなく、現在開発中のROS1阻害薬のほとんどに耐性を示します。このROS1-G2032R変異はALK-G1202R多剤耐性変異(注6)と立体構造上ほとんど同じ位置に存在します。ALKとROS1のチロシンキナーゼは相同性が非常に高いため、複数のALK阻害薬がROS1阻害薬としても開発されてきた経緯があります。中でもALK-G1202R変異有効な第3世代ALK阻害薬ロルラチニブは、ROS1に対して非常に高い阻害活性を有することが示されています。しかしながら、ロルラチニブはROS1-G2032Rに対する阻害活性はほとんどありませんでした。また、私たちは以前、細胞レベルの実験において、甲状腺がんおよび腎臓がんの治療薬として承認されているマルチキナーゼ阻害薬(注7)カボザンチニブがROS1-G2032Rに対して比較的高い阻害活性を示すことを発見し報告してきました (Katayama R et al, Clin Cancer Res 2015, 21:166-74.)。しかし、カボザンチニブは、動物モデル等における有効性は不明であり、また臨床的にもしばしば副作用等により、投薬用量を制限する必要が生じているとのことであるため、ROS1のG2032R耐性変異を克服できる薬剤の開発が期待されています。
また、NTRK遺伝子ファミリーでは、低頻度ながらTPM3-NTRK1のような融合遺伝子がドライバーがん遺伝子として、肺がん、甲状腺がんをはじめ様々ながん腫で認められており、NTRK融合遺伝子陽性のがんには、エヌトレクチニブやラロトレチニブのようなNTRK阻害薬が有効であることが示されています。
今回我々の研究において、第一三共が創製した新規ROS1/NTRK阻害薬であるDS-6051bが、ROS1-G2032R変異および他のクリゾチニブ耐性変異を阻害できる可能性があること、さらに、低濃度でNTRK融合遺伝子陽性がん細胞の増殖を抑制し、これまでに報告されたNTRK阻害薬耐性変異体のいくつかにも阻害活性を示すことを、in vitro, in vivoの実験において明らかにいたしました。
研究内容
DS-6051bについて
DS-6051bは選択性の高いROS1/NTRKキナーゼ阻害薬として第一三共により創製されました。in vitroでのキナーゼアッセイの結果、ROS1を1 nM以下の低濃度で阻害する活性を持つことが明らかになりました。さらに、NTRK1, NTRK2, NTRK3についても、10 nM以下の低濃度で阻害することが確認されました。ROS1、NTRK以外には、ALKやACKの阻害活性も見られましたが、そのほかのキナーゼに対する阻害活性は弱く、選択性の高いROS1/NTRK阻害薬であることが明らかになりました。
DS-6051bの抗腫瘍効果に関する評価
次に、IL-3依存的に増殖するマウスProB細胞のBa/F3細胞に、CD74-ROS1融合遺伝子を導入し、IL-3無しでもCD74-ROS1融合遺伝子からの増殖シグナルに依存して増える細胞株を樹立し、薬剤感受性を比較しました。その結果、DS-6051bはクリゾチニブよりも約3倍程度低い数nMの濃度で増殖抑制することが明らかになりました。ROS1融合遺伝子陽性肺がんの細胞株は、これまでに樹立されたものが1株しかなかったため、がん研究会有明病院呼吸器内科およびマサチューセッツ総合病院がんセンターの協力のもと、IRBに承認されたプロトコールに則り、同意が得られた患者さんからROS1融合遺伝子陽性肺がん細胞株を複数樹立することに成功しました。これらを用いて、DS-6051bを含む様々なROS1阻害薬への感受性を比較した結果、DS-6051bはロルラチニブに次いで2番目に低い濃度で阻害活性を示しました。さらに、ROS1融合遺伝子陽性肺がん患者由来の腫瘍を移植された担癌マウスに、経口投与でDS-6051bを連日投与すると、腫瘍が縮小していく様子が観察されました。また、NTRK1融合遺伝子を有する大腸がん細胞株KM12を用いた検討においても、10 nM以下の濃度での細胞株の増殖抑制と、KM12細胞を移植した担癌マウスモデルでの抗腫瘍効果が確認されました。
ROS1阻害薬耐性変異体に対するDS-6051bの有効性評価
次に、クリゾチニブ耐性を示す5種類のROS1変異(L1951R, S1986F, L2026M, G2032R, D2033N)型CD74-ROS1をBa/F3細胞に発現させて薬剤感受性を評価しました。その結果DS-6051bは、D2033N以外の変異型CD74-ROS1発現Ba/F3細胞の増殖を20 nM以下の低濃度で阻害し、特にG2032Rに対しては、他のROS1阻害薬と比較して最も低い濃度で細胞増殖抑制とリン酸化ROS1(ROS1の活性化の指標)の減少を認めました。CD74-ROS1-G2032R発現Ba/F3細胞をマウスに移植した担癌モデルにおいても、DS-6051bの経口投与により腫瘍の縮小を認め、さらにROS1融合遺伝子陽性肺がん細胞株HCC78細胞にG2032R変異型ROS1を過剰発現した細胞を移植した担癌マウスモデルにおいても、DS-6051bの経口投与により、長期にわたる腫瘍縮小の維持が確認されました。
本研究の結果は、ROS1融合遺伝子陽性またはNTRK融合遺伝子陽性肺がんの将来的な治療開発に貢献しうる成果であると考えられます。DS-6051bは本邦および米国を中心にROS1融合遺伝子陽性またはNTRK融合遺伝子陽性がんを対象に臨床試験が行われており、今後実用化されるためには安全性と有効性を引き続き評価していく必要があります。
5.本研究への支援
本研究は、下記機関より資金的支援等を受けて実施されました。
・国立研究開発法人日本医療研究開発機構(AMED) 次世代がん医療創生研究事業(P-CREATE)
「異分野先端技術融合による薬剤抵抗性を標的とした革新的複合治療戦略の開発」ほか
・独立行政法人日本学術振興会 科学研究費補助金
・文部科学省科学研究費助成事業
新学術領域研究「細胞社会ダイバーシティーの統合的解明と制御」
・公益財団法人 車両競技公益資金記念財団
・公益財団法人 日本財団
6.用語解説
(注1)ROS1融合遺伝子
ROS1は細胞膜上に発現するチロシンキナーゼ受容体であり、その活性化を担うリガンドは未同定です。通常は、おそらくリガンドの結合によりROS1は活性化し、細胞増殖シグナルを活性化すると考えられています。しかし、ALK融合遺伝子の様に染色体の転座や逆位などにより別の遺伝子と融合することで、恒常的に発現するとともに常に異常活性化した状態となり、細胞増殖シグナルが常時活性化して、がん化が引き起こされています。ROS1融合遺伝子陽性のがん細胞はROS1チロシンキナーゼの活性に依存して生存・増殖しているため、ROS1チロシンキナーゼ阻害薬により、細胞の生存・増殖が抑制されます。
(注2)非小細胞肺がん
肺がんとは、気管支や肺胞の細胞が何らかの原因でがん化したものであり、組織型により非小細胞肺がん(約85%)と小細胞肺がん(約15%)の2つに大きく分けられています。非小細胞肺がんは腺がん、扁平上皮がん、大細胞がんの3つに組織分類されます。このうち、喫煙との関連が大きいがんが肺扁平上皮がんと小細胞肺がんであり、ALK融合遺伝子、ROS1融合遺伝子やEGFR活性化変異などのドライバーがん遺伝子が見つかるのは、ほとんどが肺腺がんです。
(注3)G2032R変異(ROS1-G2032R耐性変異)
ROS1のキナーゼ領域は1945番目〜2215番目の約270アミノ酸から構成され、そのなかにATP(やATPの結合を阻害する分子標的薬)が結合できるポケットのような構造があります。そのポケットの入り口にあたるアミノ酸(2032番目のグリシン[G])が遺伝子変異によりアルギニン[R]に変わることで、クリゾチニブなどのROS1阻害薬は結合しにくくなりますがATPの結合は阻害されないため、ROS1チロシンキナーゼの活性は維持されて薬剤耐性となります。
(注4)チロシンキナーゼ
キナーゼとは基質をリン酸化する酵素の総称であり、そのうちチロシンキナーゼは基質たんぱくのチロシン残基をリン酸化する酵素のことです。受容体型チロシンキナーゼの多くは、その活性化により細胞の増殖を促進します。
(注5)NTRKチロシンキナーゼとNTRK融合遺伝子
NTRKはヒトではNTRK1, NTRK2, NTRK3の3つのファミリーたんぱく質があり、いずれも細胞膜上に発現するチロシンキナーゼ受容体です。その活性化は、NGF(神経成長因子)などのリガンドにより制御されており、細胞増殖シグナルなどを活性化すると考えられています。しかし、ROS1融合遺伝子の様に染色体の転座や逆位などにより別の遺伝子と融合することで、恒常的に発現するとともに常に異常活性化した状態となり、細胞増殖シグナルが常時活性化して、がん化が引き起こされています。NTRK融合遺伝子陽性のがん細胞も、NTRKチロシンキナーゼの活性に依存して生存・増殖しているため、NTRKチロシンキナーゼ阻害薬により、細胞の生存・増殖が抑制されます。
(注6)ALK-G1202R変異
ALKはROS1と相同性の高い受容体型チロシンキナーゼであり、肺がんにおいてALKも融合遺伝子形成によりがん化を引き起こしています。ALK融合遺伝子陽性肺がんに対しては、4剤のALKチロシンキナーゼ阻害薬が開発・承認されてきましたが、そのうちの初期に開発された3つの薬剤のいずれにも耐性を付与する変異(ALKキナーゼ領域内の変異)としてG1202R変異(1202番目のグリシン[G]が遺伝子変異によりアルギニン[R]に変わるもの)が報告されています。ALKとROS1は相同性が高く、キナーゼ領域の構造が似ており、ALKの1202番目のグリシン[G]はROS1の2032番目の[G]に相当する位置に当たります。
(注7) マルチキナーゼ阻害薬
キナーゼの活性中心であるATPが結合する部分のポケットの構造は比較的多数のキナーゼ間で類似した構造をとっています。そして、ATP結合ポケットに結合するキナーゼ阻害薬の中には、比較的多種類のキナーゼを阻害する能力を有するものがあり、マルチキナーゼ阻害薬と呼ばれています。
現在、我が国においてがんによる死因の1位は肺がんですが、その中で約1%程度の患者さんに、ROS1融合遺伝子(注1、下図)というがんを引き起こす遺伝子異常が見つかります。このタイプの進行肺がん患者さんには、現在、クリゾチニブ(ザーコリ®)とよばれる分子標的薬(ROS1の活性を阻害する薬剤)が承認されて臨床で高い有効性を示しております。しかし、ほとんどの症例において1年から数年以内にクリゾチニブへの耐性を獲得してがんが再発してしまうことが問題となっています。この耐性を引き起こすメカニズムの中で、最も高い頻度で認められているのが、ROS1融合遺伝子の変異(G2032Rなど(注3))によりクリゾチニブがROS1に結合しにくくなり阻害できなくなるというものであり、この耐性にも有効な薬剤はありませんでした。

がん研究会の片山量平らの研究グループと第一三共株式会社(以下「第一三共」)の共同研究において、第一三共が次世代ROS1/NTRK阻害薬として創製したDS-6051bが、ROS1チロシンキナーゼ(注4)とNTRKチロシンキナーゼ(注5)(NTRK1, NTRK2, およびNTRK3)を低濃度(数nMから十数nM)で阻害し、試験管内および動物実験において、腫瘍縮小効果を発揮することが示されました。また、DS-6051bはクリゾチニブへの高度耐性を示すROS1-G2032R耐性変異体にも有効であることも実験的に明らかにしました。
DS-6051bは本邦および米国を中心に、ROS1融合遺伝子陽性またはNTRK融合遺伝子陽性がんを対象に臨床試験が行われており(*2018年12月に第一三共はAnheart Therapeutics社に、DS-6051の全世界での開発、製造および販売権を供与しています)、本研究の結果は、ROS1融合遺伝子陽性またはNTRK融合遺伝子陽性肺がんの将来的な治療開発に貢献しうる成果であると考えられます。
本研究の成果は、Nature Publishing Groupオープンアクセス誌Nature Communicationsに、2019年8月9日付で公開されました。
2.ポイント
●非小細胞肺がんの約1%にROS1融合遺伝子が見つかり、ROS1阻害薬クリゾチニブが臨床応用されていますがG2032R変異などによる耐性が問題となっており、有効な治療法は確立していません。
●新たに開発された新薬候補化合物DS-6051bはROS1およびNTRKチロシンキナーゼの選択的な阻害薬であり、クリゾチニブ耐性のG2032Rに対しても有効である可能性が実験的に示されました。
●DS-6501bは日本および米国を中心としてROS1およびNTRK融合遺伝子陽性がんを対象として臨床試験が行われていますが、今後実用化されるためには安全性と有効性を引き続き評価していく必要があります。
3.論文名、著者およびその所属
○論文名
The new-generation selective ROS1/NTRK Inhibitor DS-6051b overcomes crizotinib resistant ROS1-G2032R mutation in preclinical models.
○ジャーナル名
Nature Communications (Nature Publishing Groupのオープンアクセス誌)
(※2019年8月9日付でオンラインに掲載されました。)
○著者
Ryohei Katayama1*, Bo Gong1,2, Noriko Togashi3, Masaya Miyamoto3, Masaki Kiga3, Shiho Iwasaki3, Yasuki Kamai3, Yuichi Tominaga3, Yasuyuki Takeda3, Yoshiko Kagoshima3, Yuki Shimizu1,2, Yosuke Seto1, Tomoko Oh-hara1, Sumie Koike1, Naoki Nakao4, Hiroyuki Hanzawa4, Kengo Watanabe3, Satoshi Yoda5,6, Noriko Yanagitani7, Aaron N. Hata5,6, Alice T. Shaw5,6, Makoto Nishio7, Naoya Fujita1,2, Takeshi Isoyama3*
* 責任著者
○著者の所属機関
1. (公財)がん研究会 がん化学療法センター 基礎研究部
2. 東京大学大学院 新領域創成科学研究科
3. 第一三共株式会社
4. 第一三共RDノバーレ株式会社
5. マサチューセッツ総合病院 がんセンター
6. ハーバード大学 医学部
7. (公財)がん研究会 有明病院 呼吸器内科
4.研究の詳細
背景と経緯
肺がんにおいては、様々なチロシンキナーゼを異常に活性化する変異や融合遺伝子などの発がん性ドライバー遺伝子が同定されており、これらの遺伝子産物(異常活性化したチロシンキナーゼ)を標的とする多くのチロシンキナーゼ阻害剤(TKI)が開発されてきました。このドライバーがん遺伝子のうち、未分化リンパ腫キナーゼ(ALK)やROSがん原遺伝子(ROS1)、および神経成長因子受容体(NTRK)の融合遺伝子はそれぞれ肺がんの0.1%〜5%に観察されます。ROS1融合遺伝子は、非小細胞肺がん(NSCLC)以外にも、胆管がん、膠芽腫、卵巣がん、胃がん、および結腸直腸がんでも低頻度ながら発見されています。ROS1融合遺伝子陽性のNSCLCの治療薬として、様々なROS1阻害薬が開発されてきておりますが、中でもALK / ROS1 / MET阻害薬であるクリゾチニブは、臨床試験において、7割を超える患者に高い治療効果が認められ、わが国をはじめ複数の国で承認されています。実際の臨床においてもROS1融合遺伝子陽性NSCLCに対して、クリゾチニブはほとんどの症例で顕著な腫瘍縮小効果を認めますが、数年以内にクリゾチニブに対する耐性を獲得しがんが再発することが多くの症例で確認され、問題となっています。特に、ROS1チロシンキナーゼ領域内のG2032R変異は、クリゾチニブだけでなく、現在開発中のROS1阻害薬のほとんどに耐性を示します。このROS1-G2032R変異はALK-G1202R多剤耐性変異(注6)と立体構造上ほとんど同じ位置に存在します。ALKとROS1のチロシンキナーゼは相同性が非常に高いため、複数のALK阻害薬がROS1阻害薬としても開発されてきた経緯があります。中でもALK-G1202R変異有効な第3世代ALK阻害薬ロルラチニブは、ROS1に対して非常に高い阻害活性を有することが示されています。しかしながら、ロルラチニブはROS1-G2032Rに対する阻害活性はほとんどありませんでした。また、私たちは以前、細胞レベルの実験において、甲状腺がんおよび腎臓がんの治療薬として承認されているマルチキナーゼ阻害薬(注7)カボザンチニブがROS1-G2032Rに対して比較的高い阻害活性を示すことを発見し報告してきました (Katayama R et al, Clin Cancer Res 2015, 21:166-74.)。しかし、カボザンチニブは、動物モデル等における有効性は不明であり、また臨床的にもしばしば副作用等により、投薬用量を制限する必要が生じているとのことであるため、ROS1のG2032R耐性変異を克服できる薬剤の開発が期待されています。
また、NTRK遺伝子ファミリーでは、低頻度ながらTPM3-NTRK1のような融合遺伝子がドライバーがん遺伝子として、肺がん、甲状腺がんをはじめ様々ながん腫で認められており、NTRK融合遺伝子陽性のがんには、エヌトレクチニブやラロトレチニブのようなNTRK阻害薬が有効であることが示されています。
今回我々の研究において、第一三共が創製した新規ROS1/NTRK阻害薬であるDS-6051bが、ROS1-G2032R変異および他のクリゾチニブ耐性変異を阻害できる可能性があること、さらに、低濃度でNTRK融合遺伝子陽性がん細胞の増殖を抑制し、これまでに報告されたNTRK阻害薬耐性変異体のいくつかにも阻害活性を示すことを、in vitro, in vivoの実験において明らかにいたしました。
研究内容
DS-6051bについて
DS-6051bは選択性の高いROS1/NTRKキナーゼ阻害薬として第一三共により創製されました。in vitroでのキナーゼアッセイの結果、ROS1を1 nM以下の低濃度で阻害する活性を持つことが明らかになりました。さらに、NTRK1, NTRK2, NTRK3についても、10 nM以下の低濃度で阻害することが確認されました。ROS1、NTRK以外には、ALKやACKの阻害活性も見られましたが、そのほかのキナーゼに対する阻害活性は弱く、選択性の高いROS1/NTRK阻害薬であることが明らかになりました。
DS-6051bの抗腫瘍効果に関する評価
次に、IL-3依存的に増殖するマウスProB細胞のBa/F3細胞に、CD74-ROS1融合遺伝子を導入し、IL-3無しでもCD74-ROS1融合遺伝子からの増殖シグナルに依存して増える細胞株を樹立し、薬剤感受性を比較しました。その結果、DS-6051bはクリゾチニブよりも約3倍程度低い数nMの濃度で増殖抑制することが明らかになりました。ROS1融合遺伝子陽性肺がんの細胞株は、これまでに樹立されたものが1株しかなかったため、がん研究会有明病院呼吸器内科およびマサチューセッツ総合病院がんセンターの協力のもと、IRBに承認されたプロトコールに則り、同意が得られた患者さんからROS1融合遺伝子陽性肺がん細胞株を複数樹立することに成功しました。これらを用いて、DS-6051bを含む様々なROS1阻害薬への感受性を比較した結果、DS-6051bはロルラチニブに次いで2番目に低い濃度で阻害活性を示しました。さらに、ROS1融合遺伝子陽性肺がん患者由来の腫瘍を移植された担癌マウスに、経口投与でDS-6051bを連日投与すると、腫瘍が縮小していく様子が観察されました。また、NTRK1融合遺伝子を有する大腸がん細胞株KM12を用いた検討においても、10 nM以下の濃度での細胞株の増殖抑制と、KM12細胞を移植した担癌マウスモデルでの抗腫瘍効果が確認されました。
ROS1阻害薬耐性変異体に対するDS-6051bの有効性評価
次に、クリゾチニブ耐性を示す5種類のROS1変異(L1951R, S1986F, L2026M, G2032R, D2033N)型CD74-ROS1をBa/F3細胞に発現させて薬剤感受性を評価しました。その結果DS-6051bは、D2033N以外の変異型CD74-ROS1発現Ba/F3細胞の増殖を20 nM以下の低濃度で阻害し、特にG2032Rに対しては、他のROS1阻害薬と比較して最も低い濃度で細胞増殖抑制とリン酸化ROS1(ROS1の活性化の指標)の減少を認めました。CD74-ROS1-G2032R発現Ba/F3細胞をマウスに移植した担癌モデルにおいても、DS-6051bの経口投与により腫瘍の縮小を認め、さらにROS1融合遺伝子陽性肺がん細胞株HCC78細胞にG2032R変異型ROS1を過剰発現した細胞を移植した担癌マウスモデルにおいても、DS-6051bの経口投与により、長期にわたる腫瘍縮小の維持が確認されました。
本研究の結果は、ROS1融合遺伝子陽性またはNTRK融合遺伝子陽性肺がんの将来的な治療開発に貢献しうる成果であると考えられます。DS-6051bは本邦および米国を中心にROS1融合遺伝子陽性またはNTRK融合遺伝子陽性がんを対象に臨床試験が行われており、今後実用化されるためには安全性と有効性を引き続き評価していく必要があります。
5.本研究への支援
本研究は、下記機関より資金的支援等を受けて実施されました。
・国立研究開発法人日本医療研究開発機構(AMED) 次世代がん医療創生研究事業(P-CREATE)
「異分野先端技術融合による薬剤抵抗性を標的とした革新的複合治療戦略の開発」ほか
・独立行政法人日本学術振興会 科学研究費補助金
・文部科学省科学研究費助成事業
新学術領域研究「細胞社会ダイバーシティーの統合的解明と制御」
・公益財団法人 車両競技公益資金記念財団
・公益財団法人 日本財団
6.用語解説
(注1)ROS1融合遺伝子
ROS1は細胞膜上に発現するチロシンキナーゼ受容体であり、その活性化を担うリガンドは未同定です。通常は、おそらくリガンドの結合によりROS1は活性化し、細胞増殖シグナルを活性化すると考えられています。しかし、ALK融合遺伝子の様に染色体の転座や逆位などにより別の遺伝子と融合することで、恒常的に発現するとともに常に異常活性化した状態となり、細胞増殖シグナルが常時活性化して、がん化が引き起こされています。ROS1融合遺伝子陽性のがん細胞はROS1チロシンキナーゼの活性に依存して生存・増殖しているため、ROS1チロシンキナーゼ阻害薬により、細胞の生存・増殖が抑制されます。
(注2)非小細胞肺がん
肺がんとは、気管支や肺胞の細胞が何らかの原因でがん化したものであり、組織型により非小細胞肺がん(約85%)と小細胞肺がん(約15%)の2つに大きく分けられています。非小細胞肺がんは腺がん、扁平上皮がん、大細胞がんの3つに組織分類されます。このうち、喫煙との関連が大きいがんが肺扁平上皮がんと小細胞肺がんであり、ALK融合遺伝子、ROS1融合遺伝子やEGFR活性化変異などのドライバーがん遺伝子が見つかるのは、ほとんどが肺腺がんです。
(注3)G2032R変異(ROS1-G2032R耐性変異)
ROS1のキナーゼ領域は1945番目〜2215番目の約270アミノ酸から構成され、そのなかにATP(やATPの結合を阻害する分子標的薬)が結合できるポケットのような構造があります。そのポケットの入り口にあたるアミノ酸(2032番目のグリシン[G])が遺伝子変異によりアルギニン[R]に変わることで、クリゾチニブなどのROS1阻害薬は結合しにくくなりますがATPの結合は阻害されないため、ROS1チロシンキナーゼの活性は維持されて薬剤耐性となります。
(注4)チロシンキナーゼ
キナーゼとは基質をリン酸化する酵素の総称であり、そのうちチロシンキナーゼは基質たんぱくのチロシン残基をリン酸化する酵素のことです。受容体型チロシンキナーゼの多くは、その活性化により細胞の増殖を促進します。
(注5)NTRKチロシンキナーゼとNTRK融合遺伝子
NTRKはヒトではNTRK1, NTRK2, NTRK3の3つのファミリーたんぱく質があり、いずれも細胞膜上に発現するチロシンキナーゼ受容体です。その活性化は、NGF(神経成長因子)などのリガンドにより制御されており、細胞増殖シグナルなどを活性化すると考えられています。しかし、ROS1融合遺伝子の様に染色体の転座や逆位などにより別の遺伝子と融合することで、恒常的に発現するとともに常に異常活性化した状態となり、細胞増殖シグナルが常時活性化して、がん化が引き起こされています。NTRK融合遺伝子陽性のがん細胞も、NTRKチロシンキナーゼの活性に依存して生存・増殖しているため、NTRKチロシンキナーゼ阻害薬により、細胞の生存・増殖が抑制されます。
(注6)ALK-G1202R変異
ALKはROS1と相同性の高い受容体型チロシンキナーゼであり、肺がんにおいてALKも融合遺伝子形成によりがん化を引き起こしています。ALK融合遺伝子陽性肺がんに対しては、4剤のALKチロシンキナーゼ阻害薬が開発・承認されてきましたが、そのうちの初期に開発された3つの薬剤のいずれにも耐性を付与する変異(ALKキナーゼ領域内の変異)としてG1202R変異(1202番目のグリシン[G]が遺伝子変異によりアルギニン[R]に変わるもの)が報告されています。ALKとROS1は相同性が高く、キナーゼ領域の構造が似ており、ALKの1202番目のグリシン[G]はROS1の2032番目の[G]に相当する位置に当たります。
(注7) マルチキナーゼ阻害薬
キナーゼの活性中心であるATPが結合する部分のポケットの構造は比較的多数のキナーゼ間で類似した構造をとっています。そして、ATP結合ポケットに結合するキナーゼ阻害薬の中には、比較的多種類のキナーゼを阻害する能力を有するものがあり、マルチキナーゼ阻害薬と呼ばれています。
関連PDF
- ニュースリリース文書
 (666.6KB )
(666.6KB )