【ニュースリリース】がん細胞が陥る染色体分配メカニズムの“死角”を発見
2021年03月01日
がん研究会がん研究所・実験病理部の広田亨(ひろたとおる)部長の研究チームは、多くのがんで広く観察され、がんの悪性度と強く関連する異数体細胞(染色体数が多様に変化した細胞)が発生するメカニズムを発見しました。
がんの手強さは病勢の進行にともない増大する「細胞のヘテロ性」に負うところが大きく、その一因として、細胞の異数体化が注目されています。がん細胞は増えるたびに異数体細胞を作り出してしまうという現象自体は広く知られていましたが、そのメカニズムは十分に説明できていませんでした。このほど、研究チームが細胞分裂期(M期)における分裂の過程を調べたところ、多くのがん細胞は「M期がスムーズに進行しない」ことを見出したことを契機にして、がん細胞の異数体化の原因を明らかにしました。
すべての細胞には、染色体数が変動しないように、染色体を分ける微小管が染色体と正しく結合するまでM期の進行にブレーキをかける「M期チェックポイント」が備わっています。細胞は、毎回の分裂でこのブレーキを解除することで染色体の分配を進めますが、今回、ブレーキ解除の分子メカニズムの究明を通じて、がん細胞のM期進行の遅滞の原因を突き止めることに成功しました。さらにこの遅延は、分配されるべき染色体ペアをつなぎとめるタンパク質を分解する酵素セパレースの活性化をさまたげ、その結果、染色体の分配エラーを誘導することを見出しました。つまり、M期チェックポイントは、本来、過不足のない染色体の分配を監視する重要な細胞機能ですが、その解除が滞ると染色体分配エラーを起こし、異数体細胞を作ってしまうという「死角」があることを発見しました。特記すべきことに、この一連の変化は、さまざまなタイプのがん細胞に共通して見つかり、進行がんの細胞がヘテロ性の獲得する一般的な病理経路であると考えられます。
これらの成果は、二報の論文として発表し、米国の科学雑誌「Current Biology」(2021年3月1日付)及び「Cell Reports」(2021年1月19日付)に掲載されました。
ポイント
○ がん細胞は増殖するときになぜ多様な異数体細胞をつくりだしてしまうのか、その分子メカニズムを解明しました。
○ 多くのがん細胞は、M期チェックポイントの解除過程に問題があるために、M期の進行が遅滞することを見出しました。
○ M期の進行の遅れは、セパレースの活性化をさまたげて、染色体分配エラーを誘導することを発見しました。
○ 多くのがん細胞に共通した変化を見出したことにより、それを標的とした新しい抗がん治療薬に道筋が立てられました。
1.研究の背景
今日のがん医療では、がん化に関わるドライバー遺伝子の解析が標準化され、それを標的とする治療が行われています。その一方で、特定のドライバー遺伝子の変化によって説明できる病態は部分的であることもわかってきました。それに代わって注目されているのは、大規模な染色体レベルの変化ですが、多数の遺伝子の機能に影響を及ぼすために、悪性化に関わる原因をピンポイントで特定することが困難です。さらに厄介なことに、細胞が分裂するたびに染色体の数や構造が変動するために、さまざまな核型をもったがん細胞をつくり出します。この現象はがん細胞の異数体化と呼ばれ、多様な性質をもつヘテロな細胞集団を形成することで、細胞増殖により有利な細胞を生み出すと考えられています。異数体化は、進行したがんの多くに観察され治療抵抗性と関連する重大な問題ですが、異数体化の促進を説明する遺伝子の変化は乏しく、その研究は大きく立ち遅れています。
がん研究会がん研究所実験病理部の広田亨部長らの研究グループでは、異数体細胞をつくりだす現場である「細胞分裂期(M期)」の解析を重ねてきました。がん細胞に共通する特徴を抽出したところ、M期の進行が遅延していることを見出しました。その分子メカニズムの解明からがん細胞の異数体化の原因を突き止めることに成功しました。
2.研究の内容
研究グループでは、がん細胞で見られるM期進行の遅延の背景を探ることによって、異数体細胞をつくり出す原因を分子レベルで説明する知見を得ることに成功し、このほど、次の二つの論文として発表しました。
1) M期チェックポイントの解除過程のメカニズムとその重要性について
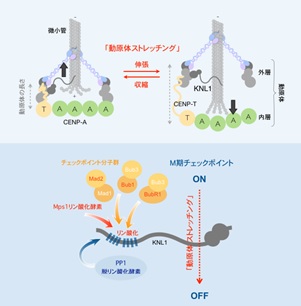
細胞には、すべての染色体が微小管と結合されるまでM期を停止するM期チェックポイントというブレーキ機能が備わっており、それによって染色体の均等分配を保障しています。染色体の中央部につくられる動原体と微小管とが結合することによってこのブレーキが解除されますが、研究グループは、今回の研究で、その解除には「動原体ストレッチング」と呼ばれる、同研究グループが発見した現象が重要なはたらきをもつことを見出しました(図1/上)。
具体的には、動原体構成分子KNL1において、リン酸化酵素が優位の状態(チェックポイントON)から脱リン酸化酵素が優位の状態(OFF)への転換を、ストレッチングが促進することを見出し、それによってM期がスムーズに進行することができることがわかりました(図1/下)。
しかし、がん細胞では、動原体ストレッチングが不足しているために、チェックポイントの解除が滞ることを発見しました。その結果として遅滞するM期の進行は、染色体分配異常を引き起こすことが判明し、M期チェックポイントの解除過程を速やかに進めることがいかに重要であるかが明らかになりました。
2) M期進行の遅滞によるセパレースの活性動態の変化が染色体分配異常の誘導
分裂期における染色体の分離は、タンパク質分解酵素であるセパレースが染色体ペアをつなぎ止めているコヒーシンを分解することで引き起こされます。研究グループはこれまでの研究でセパレースの活性プローブを開発して、セパレースが後期の開始直前に(約60秒前)急激に活性化することを見出していましたが、そうした急峻な活性化の意義はわかっていませんでした。
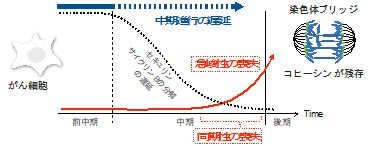
今回の研究で、さまざまながん細胞株におけるセパレースの活性化プロファイルを検討したところ、がん細胞ではいずれもセパレースの急峻な活性化がみられないことを見出しました(図2:急峻性の喪失)。がん細胞では、M期が延長しているあいだに、後期開始よりも~300秒以上も前から活性化し始め、セパレース分子が同期して活性しないために、ピーク時の活性化レベルが十分に上昇しないことが判明しました(図2:同期性の喪失)。
興味深いことに、正常二倍体細胞で、M期を実験的に延長するだけでセパレースの活性化の急峻性が喪失し、切れ残ったコヒーシンが原因で、染色体分配異常が発生しました。また逆にがん細胞で、延長しているM期を短縮すると、セパレースの活性化の急峻性は回復して染色体分配エラーの発生が抑えられました。これらの観察から、M期進行の遅れはセパレースの活性不全による染色体分配異常を導くことが明らかになりました(図2)。
これらの研究により、速やかにM期を進めるためのメカニズムが見出され、それに基づいて、がん細胞の異数体化の原因の一端を説明できるようになりました。
3.今後の展開
がんの進行に伴って顕著になるがん細胞の多様性が、がんの悪性化に関与し、治療を難しくしています。多様化するがん細胞の後追い治療をするのではなく、多様性を生み出している「原因」に着眼した治療が実現すれば、多くの進行癌の制御できるようになることが期待され、世界中でこれを目指した研究が進んでいます。本研究で明らかにした、異数体細胞を作り出してしまう病理経路に着目することによって、多くのがん細胞が陥っている変化を標的とする抗がん治療薬の開発に、具体的な道筋が立てることが可能になります。がんの病勢とともにその変化が顕著になることを考えると、そこに作用点をもつ治療薬は、既存の治療薬に不応となったケースにも有効な選択肢を提供するものになると期待されます。
4.用語の補足説明
異数体細胞・・・ヒトの体細胞は46本の染色体を持ち、その46本以外の染色体数を持つ細胞を異数体という。細胞が分裂する際に、染色体を過不足なく二つの細胞に分配する過程の異常によって生じることが知られているが、なかでも、微小管という紐と染色体との結合異常が主な原因と考えられている。
細胞分裂期(M期)・・・増殖する細胞が分裂する時期のことで、複製したDNAが凝縮して染色体となり、それを二つの細胞に分配する一連の過程が順次進行する。これを糸のように見える染色体の出現を特徴とする有糸分裂Mitosisといい、その頭文字をとってM期とも呼ばれる。
M期チェックポイント・・・細胞内のすべての染色体が微小管と結合されるまでM期の進行を停止する機能で、それによって染色体の不均等分配が起こらないように保障している。微小管と結合することによってこの機能は不活性化するが、がん細胞ではこの不活性化の過程に問題があることが本研究で明らかになった。
5.発表論文の掲載雑誌
雑誌名: Current Biology (3月1日午前11:00米国東部標準時刻)
DOI: org/10.1016/j.cub.2021.01.062
論文タイトル: Kinetochore stretching-mediated rapid silencing of the spindle-assembly checkpoint required for failsafe chromosome segregation
著者:
Kazuhiko S.K. Uchida,1, 2 Minji Jo,1 Kota Nagasaka,1,6 Motoko Takahashi,1 Norihisa Shindo,1 Katsushi Shibata,2 Kozo Tanaka,3 Hiroshi Masumoto,4 Tatsuo Fukagawa,5 and Toru Hirota1*
所属:
1. Division of Experimental Pathology, Cancer Institute of the Japanese Foundation for Cancer Research (JFCR), 3-8-31 Ariake, Koto-ku, Tokyo 135-8550, Japan.
2. Faculty of Pharmaceutical Sciences, Himeji Dokkyo University, Himeji, Japan.
3. Department of Molecular Oncology, Institute of Development, Aging and Cancer, Tohoku University, Sendai, Japan.
4. Laboratory of Chromosome Engineering, Kazusa DNA Research Institute, Kisarazu, Japan.
5. Laboratory of Chromosome Biology, Graduate School of Frontier Biosciences, Osaka University, Osaka, Japan.
6. Present address: Research Institute of Molecular Pathology, Vienna, Austria.
雑誌名: Cell Reports (1月19日午前11:00米国東部標準時刻)
DOI: org/10.1016/j.celrep.2020.108652
論文タイトル: Prolonged mitosis causes separase deregulation and chromosome nondisjunction
著者:
Norihisa Shindo,1 Makoto Otsuki,1 Kazuhiko S. K. Uchida,1 and Toru Hirota1*
所属:
1. Division of Experimental Pathology, Cancer Institute of the Japanese Foundation for Cancer Research (JFCR), 3-8-31 Ariake, Koto-ku, Tokyo 135-8550, Japan.
6.本研究の支援
本研究は、主に下記機関より資金的支援を受けて実施されました。
・文部科学省科学研究費補助金 基盤研究(A)、若手研究(A)、新学術領域研究
・上原財団研究助成金
がんの手強さは病勢の進行にともない増大する「細胞のヘテロ性」に負うところが大きく、その一因として、細胞の異数体化が注目されています。がん細胞は増えるたびに異数体細胞を作り出してしまうという現象自体は広く知られていましたが、そのメカニズムは十分に説明できていませんでした。このほど、研究チームが細胞分裂期(M期)における分裂の過程を調べたところ、多くのがん細胞は「M期がスムーズに進行しない」ことを見出したことを契機にして、がん細胞の異数体化の原因を明らかにしました。
すべての細胞には、染色体数が変動しないように、染色体を分ける微小管が染色体と正しく結合するまでM期の進行にブレーキをかける「M期チェックポイント」が備わっています。細胞は、毎回の分裂でこのブレーキを解除することで染色体の分配を進めますが、今回、ブレーキ解除の分子メカニズムの究明を通じて、がん細胞のM期進行の遅滞の原因を突き止めることに成功しました。さらにこの遅延は、分配されるべき染色体ペアをつなぎとめるタンパク質を分解する酵素セパレースの活性化をさまたげ、その結果、染色体の分配エラーを誘導することを見出しました。つまり、M期チェックポイントは、本来、過不足のない染色体の分配を監視する重要な細胞機能ですが、その解除が滞ると染色体分配エラーを起こし、異数体細胞を作ってしまうという「死角」があることを発見しました。特記すべきことに、この一連の変化は、さまざまなタイプのがん細胞に共通して見つかり、進行がんの細胞がヘテロ性の獲得する一般的な病理経路であると考えられます。
これらの成果は、二報の論文として発表し、米国の科学雑誌「Current Biology」(2021年3月1日付)及び「Cell Reports」(2021年1月19日付)に掲載されました。
ポイント
○ がん細胞は増殖するときになぜ多様な異数体細胞をつくりだしてしまうのか、その分子メカニズムを解明しました。
○ 多くのがん細胞は、M期チェックポイントの解除過程に問題があるために、M期の進行が遅滞することを見出しました。
○ M期の進行の遅れは、セパレースの活性化をさまたげて、染色体分配エラーを誘導することを発見しました。
○ 多くのがん細胞に共通した変化を見出したことにより、それを標的とした新しい抗がん治療薬に道筋が立てられました。
1.研究の背景
今日のがん医療では、がん化に関わるドライバー遺伝子の解析が標準化され、それを標的とする治療が行われています。その一方で、特定のドライバー遺伝子の変化によって説明できる病態は部分的であることもわかってきました。それに代わって注目されているのは、大規模な染色体レベルの変化ですが、多数の遺伝子の機能に影響を及ぼすために、悪性化に関わる原因をピンポイントで特定することが困難です。さらに厄介なことに、細胞が分裂するたびに染色体の数や構造が変動するために、さまざまな核型をもったがん細胞をつくり出します。この現象はがん細胞の異数体化と呼ばれ、多様な性質をもつヘテロな細胞集団を形成することで、細胞増殖により有利な細胞を生み出すと考えられています。異数体化は、進行したがんの多くに観察され治療抵抗性と関連する重大な問題ですが、異数体化の促進を説明する遺伝子の変化は乏しく、その研究は大きく立ち遅れています。
がん研究会がん研究所実験病理部の広田亨部長らの研究グループでは、異数体細胞をつくりだす現場である「細胞分裂期(M期)」の解析を重ねてきました。がん細胞に共通する特徴を抽出したところ、M期の進行が遅延していることを見出しました。その分子メカニズムの解明からがん細胞の異数体化の原因を突き止めることに成功しました。
2.研究の内容
研究グループでは、がん細胞で見られるM期進行の遅延の背景を探ることによって、異数体細胞をつくり出す原因を分子レベルで説明する知見を得ることに成功し、このほど、次の二つの論文として発表しました。
1) M期チェックポイントの解除過程のメカニズムとその重要性について
細胞には、すべての染色体が微小管と結合されるまでM期を停止するM期チェックポイントというブレーキ機能が備わっており、それによって染色体の均等分配を保障しています。染色体の中央部につくられる動原体と微小管とが結合することによってこのブレーキが解除されますが、研究グループは、今回の研究で、その解除には「動原体ストレッチング」と呼ばれる、同研究グループが発見した現象が重要なはたらきをもつことを見出しました(図1/上)。
具体的には、動原体構成分子KNL1において、リン酸化酵素が優位の状態(チェックポイントON)から脱リン酸化酵素が優位の状態(OFF)への転換を、ストレッチングが促進することを見出し、それによってM期がスムーズに進行することができることがわかりました(図1/下)。
しかし、がん細胞では、動原体ストレッチングが不足しているために、チェックポイントの解除が滞ることを発見しました。その結果として遅滞するM期の進行は、染色体分配異常を引き起こすことが判明し、M期チェックポイントの解除過程を速やかに進めることがいかに重要であるかが明らかになりました。

図1
2) M期進行の遅滞によるセパレースの活性動態の変化が染色体分配異常の誘導
分裂期における染色体の分離は、タンパク質分解酵素であるセパレースが染色体ペアをつなぎ止めているコヒーシンを分解することで引き起こされます。研究グループはこれまでの研究でセパレースの活性プローブを開発して、セパレースが後期の開始直前に(約60秒前)急激に活性化することを見出していましたが、そうした急峻な活性化の意義はわかっていませんでした。
今回の研究で、さまざまながん細胞株におけるセパレースの活性化プロファイルを検討したところ、がん細胞ではいずれもセパレースの急峻な活性化がみられないことを見出しました(図2:急峻性の喪失)。がん細胞では、M期が延長しているあいだに、後期開始よりも~300秒以上も前から活性化し始め、セパレース分子が同期して活性しないために、ピーク時の活性化レベルが十分に上昇しないことが判明しました(図2:同期性の喪失)。
興味深いことに、正常二倍体細胞で、M期を実験的に延長するだけでセパレースの活性化の急峻性が喪失し、切れ残ったコヒーシンが原因で、染色体分配異常が発生しました。また逆にがん細胞で、延長しているM期を短縮すると、セパレースの活性化の急峻性は回復して染色体分配エラーの発生が抑えられました。これらの観察から、M期進行の遅れはセパレースの活性不全による染色体分配異常を導くことが明らかになりました(図2)。

図2
これらの研究により、速やかにM期を進めるためのメカニズムが見出され、それに基づいて、がん細胞の異数体化の原因の一端を説明できるようになりました。
3.今後の展開
がんの進行に伴って顕著になるがん細胞の多様性が、がんの悪性化に関与し、治療を難しくしています。多様化するがん細胞の後追い治療をするのではなく、多様性を生み出している「原因」に着眼した治療が実現すれば、多くの進行癌の制御できるようになることが期待され、世界中でこれを目指した研究が進んでいます。本研究で明らかにした、異数体細胞を作り出してしまう病理経路に着目することによって、多くのがん細胞が陥っている変化を標的とする抗がん治療薬の開発に、具体的な道筋が立てることが可能になります。がんの病勢とともにその変化が顕著になることを考えると、そこに作用点をもつ治療薬は、既存の治療薬に不応となったケースにも有効な選択肢を提供するものになると期待されます。
4.用語の補足説明
異数体細胞・・・ヒトの体細胞は46本の染色体を持ち、その46本以外の染色体数を持つ細胞を異数体という。細胞が分裂する際に、染色体を過不足なく二つの細胞に分配する過程の異常によって生じることが知られているが、なかでも、微小管という紐と染色体との結合異常が主な原因と考えられている。
細胞分裂期(M期)・・・増殖する細胞が分裂する時期のことで、複製したDNAが凝縮して染色体となり、それを二つの細胞に分配する一連の過程が順次進行する。これを糸のように見える染色体の出現を特徴とする有糸分裂Mitosisといい、その頭文字をとってM期とも呼ばれる。
M期チェックポイント・・・細胞内のすべての染色体が微小管と結合されるまでM期の進行を停止する機能で、それによって染色体の不均等分配が起こらないように保障している。微小管と結合することによってこの機能は不活性化するが、がん細胞ではこの不活性化の過程に問題があることが本研究で明らかになった。
5.発表論文の掲載雑誌
雑誌名: Current Biology (3月1日午前11:00米国東部標準時刻)
DOI: org/10.1016/j.cub.2021.01.062
論文タイトル: Kinetochore stretching-mediated rapid silencing of the spindle-assembly checkpoint required for failsafe chromosome segregation
著者:
Kazuhiko S.K. Uchida,1, 2 Minji Jo,1 Kota Nagasaka,1,6 Motoko Takahashi,1 Norihisa Shindo,1 Katsushi Shibata,2 Kozo Tanaka,3 Hiroshi Masumoto,4 Tatsuo Fukagawa,5 and Toru Hirota1*
所属:
1. Division of Experimental Pathology, Cancer Institute of the Japanese Foundation for Cancer Research (JFCR), 3-8-31 Ariake, Koto-ku, Tokyo 135-8550, Japan.
2. Faculty of Pharmaceutical Sciences, Himeji Dokkyo University, Himeji, Japan.
3. Department of Molecular Oncology, Institute of Development, Aging and Cancer, Tohoku University, Sendai, Japan.
4. Laboratory of Chromosome Engineering, Kazusa DNA Research Institute, Kisarazu, Japan.
5. Laboratory of Chromosome Biology, Graduate School of Frontier Biosciences, Osaka University, Osaka, Japan.
6. Present address: Research Institute of Molecular Pathology, Vienna, Austria.
雑誌名: Cell Reports (1月19日午前11:00米国東部標準時刻)
DOI: org/10.1016/j.celrep.2020.108652
論文タイトル: Prolonged mitosis causes separase deregulation and chromosome nondisjunction
著者:
Norihisa Shindo,1 Makoto Otsuki,1 Kazuhiko S. K. Uchida,1 and Toru Hirota1*
所属:
1. Division of Experimental Pathology, Cancer Institute of the Japanese Foundation for Cancer Research (JFCR), 3-8-31 Ariake, Koto-ku, Tokyo 135-8550, Japan.
6.本研究の支援
本研究は、主に下記機関より資金的支援を受けて実施されました。
・文部科学省科学研究費補助金 基盤研究(A)、若手研究(A)、新学術領域研究
・上原財団研究助成金
関連PDF
- ニュースリリース文書
 (1,393.2KB )
(1,393.2KB )