【ニュースリリース】ヒトゲノム複製におけるDNAポリメラーゼ間の分業と複製開始領域の同定 −ゲノム安定性とDNA複製機構の関わり合い−
2022年12月01日
1.ポイント
●ヒト培養細胞を用いて,全ゲノムにわたり特定のDNAポリメラーゼが機能する領域を解析する実験方法Polymerase usage sequencing(Pu-seq)を確立しました.
●DNAポリメラーゼのゲノムプロファイルを利用して,複製が開始される領域を今までにない精度で予測することに成功しました.
●今後は,本研究で確立されたPu-seq実験の応用により,がん細胞に特異的なDNA複製の仕組みが明らかになることが期待されます.
2.概要
ヒトではDNA合成反応に働く酵素(DNAポリメラーゼ)が17種類存在し,それらのDNA合成反応の効率・正確性はそれぞれ異なり,ゲノム複製におけるポリメラーゼ間の分業は,ゲノム情報の安定性を決める主な要因です.特に,がん細胞においては,多くのDNAポリメラーゼ遺伝子に変異が生じ, DNAポリメラーゼの使われ方が大きく変化することが報告されていますが,その実態は明らかになっていません.我々は,ヒト培養細胞を使用して,全ゲノムにわたりDNAポリメーラの機能を解析する方法Polymerase usage sequencing(Pu-seq)法を開発し,主要なDNAポリメラーゼと言われていたPolε(イプシロン)とPolα(アルファ)それぞれが主にリーディング鎖・ラギング鎖合成に関与することを明らかにしました.また,これらのポリメラーゼのプロファイルを組み合わせた解析から,ゲノム上に多数存在する複製開始領域を今までにない精度で予測することにも成功しました.今後は,本研究で開発されたPu-seq実験によって,がん化などによる細胞の状態変化によって生じるゲノム複製機構の変遷を明らかにし,ヒトなどの大きなゲノムを持つ生物が潜在的に有するDNA複製の柔軟性(flexibility),また,それに伴う脆弱性(fragility)の全容解明に向け,研究を大きく進めていく予定です.
3.論文名、著者およびその所属
○論文名
Global landscape of replicative DNA polymerase usage in the human genome
○掲載誌名
Nature Communications
(※2022年11月24日にオンライン公開されました。)
○著者
Eri Koyanagi1,#, Yoko Kakimoto1,#, Tamiko Minamisawa2,#, Fumiya Yoshifuji3,#, Toyoaki Natsume4,5,†, Atsushi Higashitani3, Tomoo Ogi6, Antony M. Carr7, Masato T. Kanemaki4,5,8, Yasukazu Daigaku1,2,*
○著者の所属機関
1.東北大学 学際科学フロンティア研究所
2.(公財)がん研究会 がん研究所 がんゲノム動態プロジェクト
3.東北大学 大学院生命科学研究科
4.情報・システム研究機構 国立遺伝学研究所
5.総合研究大学院大学 遺伝学専攻
6.名古屋大学 環境医学研究所
7.サセックス大学 Genome Damage and Stability Centre(英国)
8.東京大学 大学院理学系研究科 生物科学専攻
(#同等貢献,*責任著者,†現所属:東京都医学総合研究所 ゲノム医学研究センター)
○DOI
https://doi.org/10.1038/s41467-022-34929-8
4.研究の詳細
背景と経緯
DNA合成を触媒する酵素(DNAポリメラーゼ)は,ヒトでは17種類存在し,それらのDNA合成の効率・正確性は異なります.ゲノム複製におけるDNAポリメラーゼの間での分業・協調のメカニズムは,遺伝情報の安定性を論ずる上で解明されるべき課題です.現在まで,真核生物のDNA複製機構は出芽酵母・分裂酵母など,比較的小さなゲノムDNAを持つ生物において研究が行われ.個々のDNAポリメラーゼの役割が検証されてきました(図1).一方,ヒトを含む格段に大きいゲノムを持つ哺乳類細胞においては,より多くのDNAポリメラーゼがゲノム複製に関与し,柔軟な複製機構を構築していることが示唆されています.しかし,数多くのDNAポリメラーゼがどのように分業し,滞りなくゲノム複製を行うかは,直接検証されていません.
特に,がん細胞においては,特定のDNAポリメラーゼの発現量と癌の進行速度が相関することも報告されています.また,Oncogenic activation(※4)によって,DNAポリメラーゼの使われ方が大きく変化することが示され,がん化の過程で変わりゆくDNAポリメラーゼの機能動態は,がん細胞における突然変異率の高さ・染色体不安定性と強く関連し,細胞間のHeterogeneityを生む事象であると考えられます.
研究内容
本研究は,大腸がん由来の細胞hct116を使用して,ゲノムを網羅して,特定のポリメラーゼが合成する領域を同定する実験系Polymerase usage sequencing: Pu-seqを構築しました.この実験系において, Polα(アルファ)とPolε(イプシロン)を対象として解析を実施し,複製フォークの進行に伴いPolεがリーディング鎖,Polαがラギング鎖合成に主に関与することを示し,世界で初めて,哺乳類細胞のゲノム複製におけるDNAポリメラーゼ間の分業を明らかにしました(図2上段).しかし,ゲノム複製の過程において,これらのDNAポリメラーゼの役割が一定でないことも本研究で同時に示されました.特に,遺伝子転写が盛んに起きる領域においては一本鎖DNAとして露出する部分に非B型DNA構造(※1)やDNA損傷が多く生じ,DNAポリメラーゼの進行を阻害することが示唆されました.加えて,ヒトゲノム上には,染色体異常が特に生じやすい領域:脆弱部位(common fragile site)が存在し,その中でも特に不安定な第3染色体上のFRA3B,第16染色体FRA16D領域においては,Polεのリーディング鎖合成が阻害されやすいことが示され,他のDNAポリメラーゼが置き換わってDNA合成を行っていることが予想されました.これらの結果は,DNAポリメラーゼの分業と協調はゲノム情報の安定性を決定する主要な要因の1つであることを示しています.
加えて本研究では,PolαとPolεのプロファイルをリーディング鎖,ラギング鎖プロファイルとして利用し,複製開始領域の染色体上での位置,および,その領域における開始確率を高精度に特定することにも成功しました(図2下段).得られた全ゲノムに渡る複製開始領域のプロファイルとRNA-seqによるトランスクリプトーム解析(※2)と複製開始反応の関連性を調べた結果,活発に発現する遺伝子の転写開始領域(TSS)の15-20kb程度上流域,転写終了領域(TTS)の15-20kb程度下流域で複製開始反応が起きる傾向にあることが明らかにされました.また,遺伝子の内部では逆に,複製フォークの停止反応が起きやすいことが示されました.これらの結果は,遺伝子領域付近においては,その両端で複製が開始され,遺伝子内部において両側から複製フォークが合わさり,複製が終了するということ示します(図3).また,遺伝子発現の制御においてクロマチン構造が重要な役割を果たす点を考慮し,複製開始領域でのヌクレオソーム(※3)の状態を解析した結果,ヒストン修飾(H2AZ,H3K27me3)が特に局在することが示されました.このことから,ヒトゲノム上の複製開始領域は,ゲノムの小さい酵母のようにDNAの配列情報によって構成されるものではなく,遺伝子配置やクロマチン構造などを含めた多くの要因を含んだ高次な制御機構を持つことが示され,この知見は,今後の複製開始反応機構の解明や,さらにはそれを人工的に制御する機構の開発のために重要な情報となると考えています.

今後の展開
本研究では,ヒトゲノム上でのDNAポリメラーゼの役割は予想されていた以上に変化に富むことを示すデータが多く得られています.今後,本研究で確立されたヒト細胞におけるPu-seq実験は,大きなゲノムを持つ生物におけるDNA複製の柔軟性(flexibility),または,それに伴う脆弱性(fragility)の全容を明らかにする上で,大きな役割を果たすと考えられます.特に,がん化の過程に伴う複製開始機構,および,DNAポリメラーゼの機能動態の変化を対象とした解析を行うことにより,様々ながん細胞に特異的なDNA複製の仕組みや,それに寄与する因子を特定することが可能となり,診断・創薬の標的となる細胞内の現象・分子の同定が期待されます.
5.本研究への支援
本研究は、以下の支援を受けて実施されました。
・国立研究開発法人科学技術振興機構(JST)戦略的創造研究推進事業 さきがけ 研究領域:ゲノムスケールのDNA設計・合成による細胞制御技術の創出「レプリケーター領域の構成的理解を介したゲノム複製の制御技術の確立(研究代表者:大学保一)」
・国立研究開発法人科学技術振興機構(JST) 創発的研究支援事業 塩見パネル「ゲノム複製におけるDNAポリメラーゼ間の協調的機能(研究代表者:大学保一)」
・日本学術振興会(JSPS)科学研究費補助金 JP16H06151, JP20H03233,JP21K19203(研究代表:大学保一)
・日本学術振興会(JSPS)科学研究費補助金 JP20H05396, JP21H04719 and JP22H04703(研究代表:鐘巻将人)
・内藤記念科学振興財団 研究助成(研究代表者:大学保一)
・武田科学振興財団 ライフサイエンス研究助成(研究代表者:大学保一)
・国立遺伝学研究所 共同研究「NIG-JOINT」(研究代表者:大学保一)
6.用語解説
(※1)非B型DNA構造
生体内のDNAはB型構造として二重らせん構造を成すが,塩基配列の組成や一本鎖DNAの状態であることを原因として異なる構造になることがあり,DNA合成を阻害する原因となる.
(※2)トランスクリプトーム解析
細胞内のRNAの塩基配列を網羅的に解析することによる,ゲノム上のほとんどの遺伝子を対象とした発現レベルの解析.
(※3)ヌクレオソーム
DNAのパッケージングの基本的単位であり,DNAが8つのヒストンタンパク質に巻きついて,ひとつの構造単位を成す.ヒストンタンパク質はメチル化やアセチル化などの修飾の影響を受けて,その構造が変化する.
(※4)Oncogenic activation
Mycや変異型Rasのようながん遺伝子の活性化によって引き起こされる発がんストレスであり,早期のS期への進行による複製開始点の減少や,複製コンポーネントの枯渇を原因とした複製ストレスの原因となる.
●ヒト培養細胞を用いて,全ゲノムにわたり特定のDNAポリメラーゼが機能する領域を解析する実験方法Polymerase usage sequencing(Pu-seq)を確立しました.
●DNAポリメラーゼのゲノムプロファイルを利用して,複製が開始される領域を今までにない精度で予測することに成功しました.
●今後は,本研究で確立されたPu-seq実験の応用により,がん細胞に特異的なDNA複製の仕組みが明らかになることが期待されます.
2.概要
ヒトではDNA合成反応に働く酵素(DNAポリメラーゼ)が17種類存在し,それらのDNA合成反応の効率・正確性はそれぞれ異なり,ゲノム複製におけるポリメラーゼ間の分業は,ゲノム情報の安定性を決める主な要因です.特に,がん細胞においては,多くのDNAポリメラーゼ遺伝子に変異が生じ, DNAポリメラーゼの使われ方が大きく変化することが報告されていますが,その実態は明らかになっていません.我々は,ヒト培養細胞を使用して,全ゲノムにわたりDNAポリメーラの機能を解析する方法Polymerase usage sequencing(Pu-seq)法を開発し,主要なDNAポリメラーゼと言われていたPolε(イプシロン)とPolα(アルファ)それぞれが主にリーディング鎖・ラギング鎖合成に関与することを明らかにしました.また,これらのポリメラーゼのプロファイルを組み合わせた解析から,ゲノム上に多数存在する複製開始領域を今までにない精度で予測することにも成功しました.今後は,本研究で開発されたPu-seq実験によって,がん化などによる細胞の状態変化によって生じるゲノム複製機構の変遷を明らかにし,ヒトなどの大きなゲノムを持つ生物が潜在的に有するDNA複製の柔軟性(flexibility),また,それに伴う脆弱性(fragility)の全容解明に向け,研究を大きく進めていく予定です.

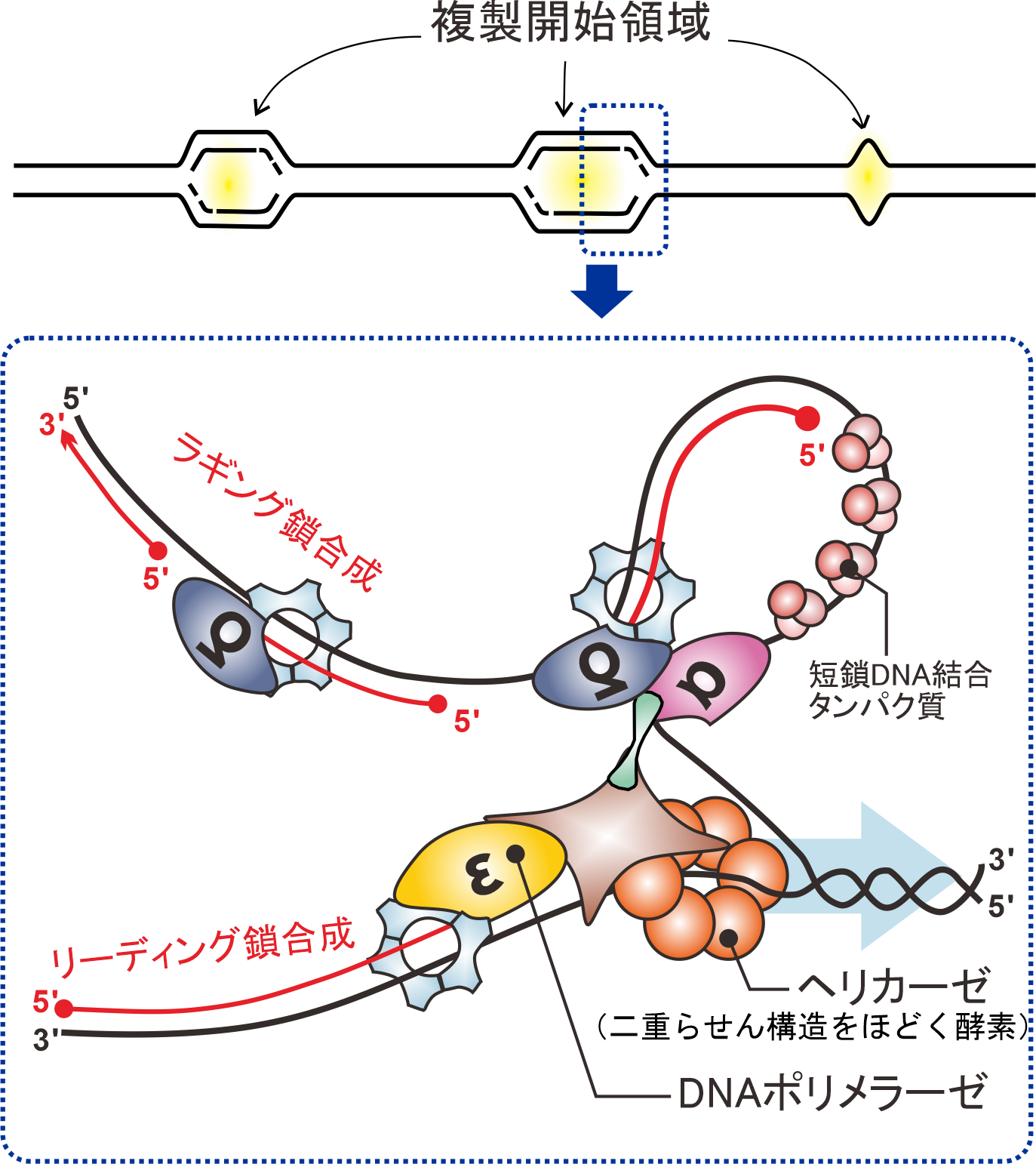
図1. DNA複製フォークの構造
ヘリカーゼがほどいた一本鎖DNA上でPolεがリーディング鎖,PolαとPolδラギング鎖合成を担う.
ヘリカーゼがほどいた一本鎖DNA上でPolεがリーディング鎖,PolαとPolδラギング鎖合成を担う.
3.論文名、著者およびその所属
○論文名
Global landscape of replicative DNA polymerase usage in the human genome
○掲載誌名
Nature Communications
(※2022年11月24日にオンライン公開されました。)
○著者
Eri Koyanagi1,#, Yoko Kakimoto1,#, Tamiko Minamisawa2,#, Fumiya Yoshifuji3,#, Toyoaki Natsume4,5,†, Atsushi Higashitani3, Tomoo Ogi6, Antony M. Carr7, Masato T. Kanemaki4,5,8, Yasukazu Daigaku1,2,*
○著者の所属機関
1.東北大学 学際科学フロンティア研究所
2.(公財)がん研究会 がん研究所 がんゲノム動態プロジェクト
3.東北大学 大学院生命科学研究科
4.情報・システム研究機構 国立遺伝学研究所
5.総合研究大学院大学 遺伝学専攻
6.名古屋大学 環境医学研究所
7.サセックス大学 Genome Damage and Stability Centre(英国)
8.東京大学 大学院理学系研究科 生物科学専攻
(#同等貢献,*責任著者,†現所属:東京都医学総合研究所 ゲノム医学研究センター)
○DOI
https://doi.org/10.1038/s41467-022-34929-8
4.研究の詳細
背景と経緯
DNA合成を触媒する酵素(DNAポリメラーゼ)は,ヒトでは17種類存在し,それらのDNA合成の効率・正確性は異なります.ゲノム複製におけるDNAポリメラーゼの間での分業・協調のメカニズムは,遺伝情報の安定性を論ずる上で解明されるべき課題です.現在まで,真核生物のDNA複製機構は出芽酵母・分裂酵母など,比較的小さなゲノムDNAを持つ生物において研究が行われ.個々のDNAポリメラーゼの役割が検証されてきました(図1).一方,ヒトを含む格段に大きいゲノムを持つ哺乳類細胞においては,より多くのDNAポリメラーゼがゲノム複製に関与し,柔軟な複製機構を構築していることが示唆されています.しかし,数多くのDNAポリメラーゼがどのように分業し,滞りなくゲノム複製を行うかは,直接検証されていません.
特に,がん細胞においては,特定のDNAポリメラーゼの発現量と癌の進行速度が相関することも報告されています.また,Oncogenic activation(※4)によって,DNAポリメラーゼの使われ方が大きく変化することが示され,がん化の過程で変わりゆくDNAポリメラーゼの機能動態は,がん細胞における突然変異率の高さ・染色体不安定性と強く関連し,細胞間のHeterogeneityを生む事象であると考えられます.

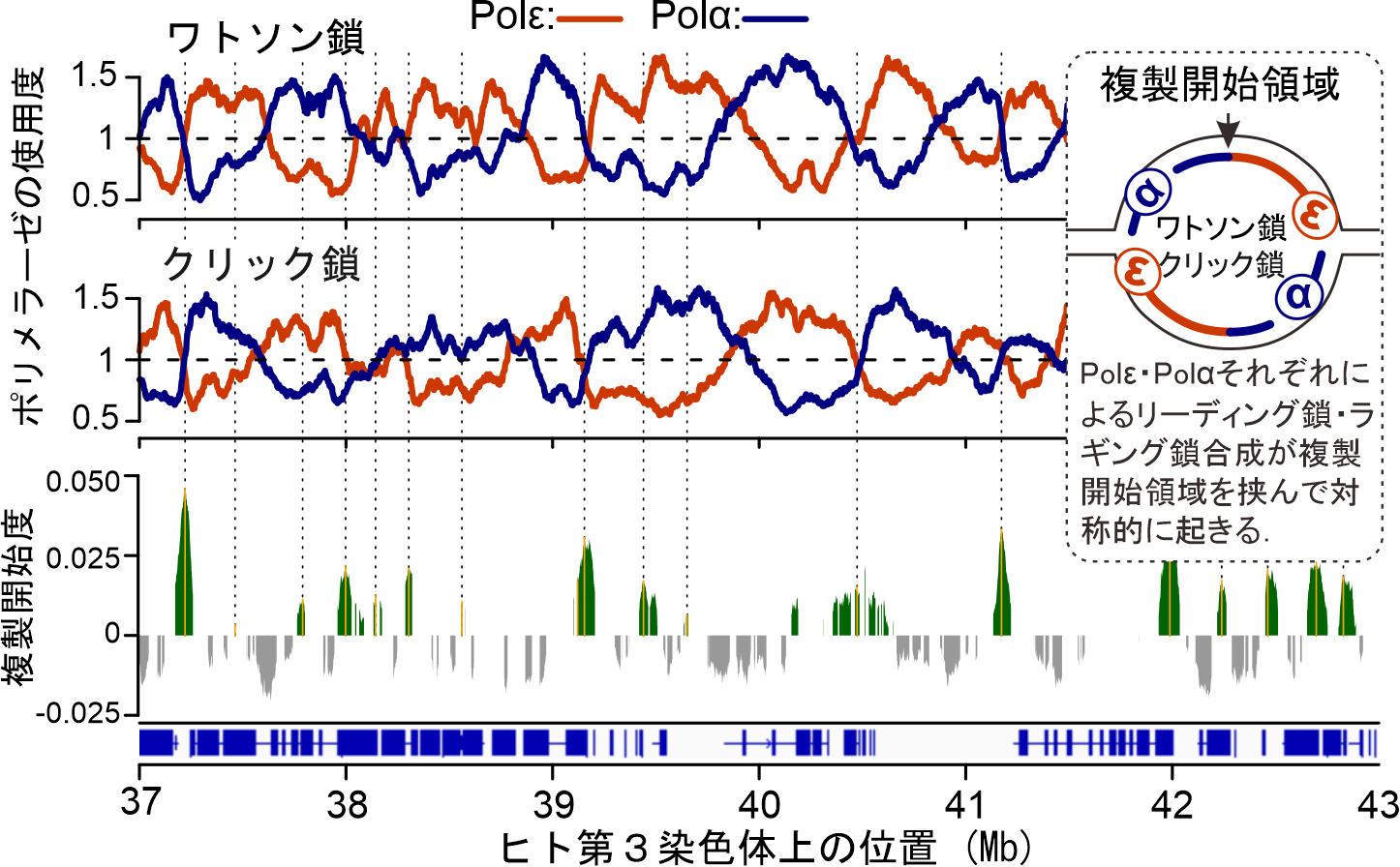
図2. ヒト培養細胞HCT116におけるPu-seq実験.
Polε,Polαの合成領域(上段 橙と青),および,それらのデータより算出された複製開始領域を予測した結果(下段 緑).
研究内容
本研究は,大腸がん由来の細胞hct116を使用して,ゲノムを網羅して,特定のポリメラーゼが合成する領域を同定する実験系Polymerase usage sequencing: Pu-seqを構築しました.この実験系において, Polα(アルファ)とPolε(イプシロン)を対象として解析を実施し,複製フォークの進行に伴いPolεがリーディング鎖,Polαがラギング鎖合成に主に関与することを示し,世界で初めて,哺乳類細胞のゲノム複製におけるDNAポリメラーゼ間の分業を明らかにしました(図2上段).しかし,ゲノム複製の過程において,これらのDNAポリメラーゼの役割が一定でないことも本研究で同時に示されました.特に,遺伝子転写が盛んに起きる領域においては一本鎖DNAとして露出する部分に非B型DNA構造(※1)やDNA損傷が多く生じ,DNAポリメラーゼの進行を阻害することが示唆されました.加えて,ヒトゲノム上には,染色体異常が特に生じやすい領域:脆弱部位(common fragile site)が存在し,その中でも特に不安定な第3染色体上のFRA3B,第16染色体FRA16D領域においては,Polεのリーディング鎖合成が阻害されやすいことが示され,他のDNAポリメラーゼが置き換わってDNA合成を行っていることが予想されました.これらの結果は,DNAポリメラーゼの分業と協調はゲノム情報の安定性を決定する主要な要因の1つであることを示しています.
加えて本研究では,PolαとPolεのプロファイルをリーディング鎖,ラギング鎖プロファイルとして利用し,複製開始領域の染色体上での位置,および,その領域における開始確率を高精度に特定することにも成功しました(図2下段).得られた全ゲノムに渡る複製開始領域のプロファイルとRNA-seqによるトランスクリプトーム解析(※2)と複製開始反応の関連性を調べた結果,活発に発現する遺伝子の転写開始領域(TSS)の15-20kb程度上流域,転写終了領域(TTS)の15-20kb程度下流域で複製開始反応が起きる傾向にあることが明らかにされました.また,遺伝子の内部では逆に,複製フォークの停止反応が起きやすいことが示されました.これらの結果は,遺伝子領域付近においては,その両端で複製が開始され,遺伝子内部において両側から複製フォークが合わさり,複製が終了するということ示します(図3).また,遺伝子発現の制御においてクロマチン構造が重要な役割を果たす点を考慮し,複製開始領域でのヌクレオソーム(※3)の状態を解析した結果,ヒストン修飾(H2AZ,H3K27me3)が特に局在することが示されました.このことから,ヒトゲノム上の複製開始領域は,ゲノムの小さい酵母のようにDNAの配列情報によって構成されるものではなく,遺伝子配置やクロマチン構造などを含めた多くの要因を含んだ高次な制御機構を持つことが示され,この知見は,今後の複製開始反応機構の解明や,さらにはそれを人工的に制御する機構の開発のために重要な情報となると考えています.

図3. 遺伝子周辺でのDNA複製フォーク動態
今後の展開
本研究では,ヒトゲノム上でのDNAポリメラーゼの役割は予想されていた以上に変化に富むことを示すデータが多く得られています.今後,本研究で確立されたヒト細胞におけるPu-seq実験は,大きなゲノムを持つ生物におけるDNA複製の柔軟性(flexibility),または,それに伴う脆弱性(fragility)の全容を明らかにする上で,大きな役割を果たすと考えられます.特に,がん化の過程に伴う複製開始機構,および,DNAポリメラーゼの機能動態の変化を対象とした解析を行うことにより,様々ながん細胞に特異的なDNA複製の仕組みや,それに寄与する因子を特定することが可能となり,診断・創薬の標的となる細胞内の現象・分子の同定が期待されます.
5.本研究への支援
本研究は、以下の支援を受けて実施されました。
・国立研究開発法人科学技術振興機構(JST)戦略的創造研究推進事業 さきがけ 研究領域:ゲノムスケールのDNA設計・合成による細胞制御技術の創出「レプリケーター領域の構成的理解を介したゲノム複製の制御技術の確立(研究代表者:大学保一)」
・国立研究開発法人科学技術振興機構(JST) 創発的研究支援事業 塩見パネル「ゲノム複製におけるDNAポリメラーゼ間の協調的機能(研究代表者:大学保一)」
・日本学術振興会(JSPS)科学研究費補助金 JP16H06151, JP20H03233,JP21K19203(研究代表:大学保一)
・日本学術振興会(JSPS)科学研究費補助金 JP20H05396, JP21H04719 and JP22H04703(研究代表:鐘巻将人)
・内藤記念科学振興財団 研究助成(研究代表者:大学保一)
・武田科学振興財団 ライフサイエンス研究助成(研究代表者:大学保一)
・国立遺伝学研究所 共同研究「NIG-JOINT」(研究代表者:大学保一)
6.用語解説
(※1)非B型DNA構造
生体内のDNAはB型構造として二重らせん構造を成すが,塩基配列の組成や一本鎖DNAの状態であることを原因として異なる構造になることがあり,DNA合成を阻害する原因となる.
(※2)トランスクリプトーム解析
細胞内のRNAの塩基配列を網羅的に解析することによる,ゲノム上のほとんどの遺伝子を対象とした発現レベルの解析.
(※3)ヌクレオソーム
DNAのパッケージングの基本的単位であり,DNAが8つのヒストンタンパク質に巻きついて,ひとつの構造単位を成す.ヒストンタンパク質はメチル化やアセチル化などの修飾の影響を受けて,その構造が変化する.
(※4)Oncogenic activation
Mycや変異型Rasのようながん遺伝子の活性化によって引き起こされる発がんストレスであり,早期のS期への進行による複製開始点の減少や,複製コンポーネントの枯渇を原因とした複製ストレスの原因となる.
関連PDF
- ニュースリリース文書
 (831.1KB )
(831.1KB )