目次
- がん分子標的薬耐性機構の解明と耐性克服薬の探索
- がん幹細胞・治療残存細胞の生存機構解析と分子標的の同定
- 生存増殖シグナル伝達系の解析と分子標的の探索
- がん免疫療法への耐性機構の解明と克服法の探索
- 血小板との相互作用を介したがん悪性化機構の解明とそれに基づく創薬
- 骨肉腫・脳腫瘍に対する新規治療標的と治療法候補の探索/li>
がん分子標的治療薬への耐性化機構の解明と克服薬の探索
がんの薬物療法は、よりがん特異的な分子標的治療薬の登場により大きな変化を遂げてきた。分子標的薬は、対象となる標的(ドライバーがん遺伝子と呼ばれるような強力にがん化を起こす遺伝子産物)を有するがんに対しては、非常に高い効果を示す一方で、治療を続けていくうちに耐性腫瘍が生じることが問題となっており、その耐性機構、耐性克服のための治療法開発が強く望まれている。我々は、数多くの分子標的薬が登場し、治療が大きく進歩しつつある肺がんを中心に、耐性メカニズムと耐性克服法の探索研究を進めている。
肺がんはがんの中で最も死亡者が多く,年間7万人以上の方が肺がんで命を落とされており、より効果的な治療法の開発が切望されている。進行肺がんでは,外科手術による治療が困難な場合が多く,薬物療法や放射線療法が中心となっている。薬物療法としては近年までは細胞障害性の抗がん剤による化学療法が中心であった、この約20年の間にEGFRチロシンキナーゼ阻害薬(GefitinibやErlotinib、Afatinib、Osimertinibなど)の登場と、EGFR活性化型変異の発見を契機に,分子標的薬の有用性が高まってきた。さらに2007年には、強力ながん遺伝子としてALK融合遺伝子が発見され、現在ではALKチロシンキナーゼ阻害薬(CrizotinibやAlectinib、Ceritinib、Lorlatinib、Brigatinib)が承認され使用されている。その後、 RET,ROS1,NTRK,RETと様々な融合遺伝子陽性肺がんが見つかっており、これらに対して各種分子標的薬の臨床試験が多数行われており、これまでにCrizotinibやEntrectinib、Larotrectinib、Selpercatinibなどの薬剤がそれぞれROS1, NTRK, RET陽性がんに対して承認されている。
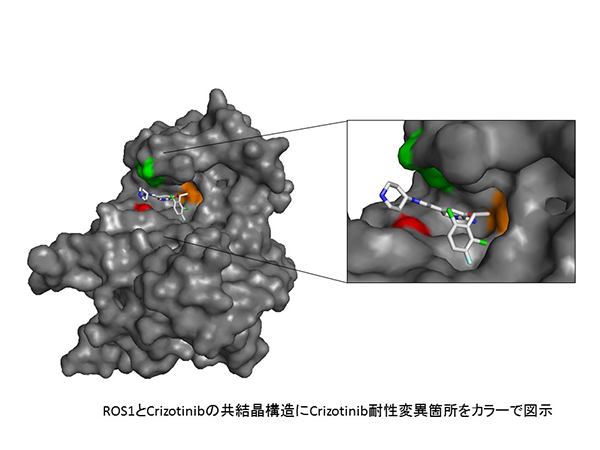
我々は、(1)培養細胞を用いて分子標的薬耐性細胞を作成し、その耐性機構について検討すること、(2)マウスに腫瘍細胞を移植したXenograftモデルを用いて、耐性腫瘍の作成および耐性機構の検索、耐性克服薬の効果の検討し、(3)実際に分子標的薬での治療を受けた患者様由来の検体(治療前、耐性獲得後の検体)を用いて耐性機構を検索する、などの方法を駆使し研究を進めている。これまでに、ALK融合遺伝子陽性肺がんに対する第2世代ALK阻害薬Alectinibに対する耐性を引き起こす変異を新たに同定し、その変異がAlectinib耐性変異を引き起こすメカニズムを立体構造シミュレーションにより明らかにし、さらにその耐性に対してCeritinibが有効であることを見出し報告してきた。また、ALK陽性肺がんにおけるCeritinib耐性機構の同定のために米国マサチューセッツ総合病院との共同研究を行い、世界に先駆けて複数の耐性機構の同定に成功している。また、最近では、第3世代ALK阻害薬Lorlatinib耐性機構とその克服薬候補を見出し、報告した。ALK融合遺伝子陽性肺がんに加えて、ROS1融合遺伝子陽性肺がんに対するROS1/ALK阻害薬Crizotinibに対する耐性を引き起こす変異を新たに同定し、さらにそれらの耐性変異に対して現在米国で甲状腺がんに承認されており、本邦においても臨床試験が進行中のCabozantinibが有効であることや、企業との共同研究からTaletrectinibの耐性変異体への有用性などを発見している。また、EGFR変異肺癌やALK融合遺伝子陽性肺がんでは2つ以上の耐性変異がキナーゼ領域内に生じることで、既存の承認薬に対し耐性となることを明らかにするとともに、その耐性克服薬候補の発見にも複数成功している。以上の様に、我々はin vitro,マウスモデル,臨床検体の解析を駆使し、耐性機構の同定と耐性克服法の発見をめざして研究を行い、より効果的な分子標的療法の開発につなげていきたいと考えている。
PUBLICATIONS (*: corresponding author)
- Utsumi T, Mizuta H, Seto Y, Uchibori K, Nishio M, Okamoto I, Katayama R. AXL-Mediated Drug Resistance in ALK-Rearranged NSCLC Enhanced by GAS6 From Macrophages and MMP11 Positive Fibroblasts. Cancer Sci. 2025 Feb 4. doi: 10.1111/cas.70006.
- Fujimura T, Furugaki K, Mizuta H, Muraoka S, Nishio M, Adachi J, Uchibori K, Miyauchi E, Hayashi H, *Katayama R, *Yoshiura S. Targeting ErbB and tankyrase1/2 prevent the emergence of drug-tolerant persister cells in ALK-positive lung cancer. NPJ Precis Oncol. 2024 Nov 17;8(1):264. doi: 10.1038/s41698-024-00757-w.
- Furugaki K, Fujimura T, Sakaguchi N, Watanabe Y, Uchibori K, Miyauchi E, Hayashi H, *Katayama R, *Yoshiura S. Combined blockade of GPX4 and activated EGFR/HER3 bypass pathways inhibits the development of ALK-inhibitor-induced tolerant persister cells in ALK-fusion-positive lung cancer. Mol Oncol. 2024 Oct 6. doi: 10.1002/1878-0261.13746.
- Wei X, Uchibori K, Kondo N, Utsumi T, Takemoto A, Koike S, Takagi S, Yanagitani N, Nishio M, *Katayama R. MIG6 loss increased RET inhibitor tolerant persister cells in RET-rearranged non-small cell lung cancer. Cancer Lett. 2024 Nov 1;604:217220. doi: 10.1016/j.canlet.2024.217220.
- Suzuki M, Uchibori K, Oh-Hara T, Nomura Y, Suzuki R, Takemoto A, Araki M, Matsumoto S, Sagae Y, Kukimoto-Niino M, Kawase Y, Shirouzu M, Okuno Y, Nishio M, Fujita N, *Katayama R. A macrocyclic kinase inhibitor overcomes triple resistant mutations in EGFR-positive lung cancer. NPJ Precis Oncol. 2024 Feb 23;8(1):46. doi: 10.1038/s41698-024-00542-9.
- Sakashita T, Yanagitani N, Koike S, Low SK, Takagi S, Baba S, Takeuchi K, Nishio M, Fujita N, *Katayama R. Fibroblast growth factor receptor 3 overexpression mediates ALK inhibitor resistance in ALK-rearranged non-small cell lung cancer. Cancer Sci. 2022 Nov;113(11):3888-3900. doi: 10.1111/cas.15529
- Shimizu Y, Okada K, Adachi J, Abe Y, Narumi R, Uchibori K, Yanagitani N, Koike S, Takagi S, Nishio M, Fujita N, *Katayama R. GSK3 inhibition circumvents and overcomes acquired lorlatinib resistance in ALK-rearranged non-small-cell lung cancer. NPJ Precis Onc. 6,16 (2022)
- Tanimura K, *Yamada T, Okada K, Nakai K, Horinaka M, Katayama Y, Morimoto K, Ogura Y, Takeda T, Shiotsu S, Ichikawa K, Watanabe S, Morimoto Y, Iwasaku M, Kaneko Y, Uchino J, Taniguchi H, Yoneda K, Matoba S, Sakai T, Uehara H, Yano S, Kusaba T, Katayama R, and Takayama K, HER3 activation contributes toward the emergence of ALK inhibitor-tolerant cells in ALK-rearranged lung cancer with mesenchymal features. NPJ Precis Onc. 6,5 (2022)
- Oguri, T., Sasada, S., Seki, S., Murata, S., Tsuchiya, Y., Ishioka, K., Takahashi, S., Seki, R., Hirose, S., Katayama, R., Nakamura, M. A case of hyperprogressive disease following atezolizumab therapy for pulmonary pleomorphic carcinoma with epidermal growth factor receptor mutation. Respir. Med. Case Rep. 33: 101405 (2021).
- Yoshizawa T, Uchibori K, Araki M, Matsumoto S, Ma B, Kanada R, Seto Y, Oh-hara T, Koike S, Ariyasu R, Kitazono S, Ninomiya H, Takeuchi K, Yanagitani N, Takagi S, Kishi, K, Fujita N, Okuno Y, Nishio M, *Katayama R. Microsecond-timescale MD simulation of EGFR minor mutation predicts the structural flexibility of EGFR kinase core that reflects EGFR inhibitor sensitivity. NPJ Prec Oncol. April 16, 5, 32 (2021). doi: ?10.1038/s41698-021-00170-7
- Ariyasu R, Uchibori K, Sasaki T, Tsukahara M, Kiyotani K, Yoshida R, Ono Y, Kitazono S, Ninomiya H, Ishikawa Y, Mizukami Y, Yanagitani N, Fujita N, Nishio M, *Katayama R. Monitoring EGFR C797S mutation in Japanese NSCLC patients with serial cell free DNA evaluation using digital droplet PCR. Cancer Sci. 2021 Jun;112(6):2371-2380. doi: 10.1111/cas.14879. Epub 2021 May 2.
- Mizuta H, Okada K, Araki M, Adachi J, Takemoto A, Kutkowska J, Maruyama K, Yanagitani N, Oh-Hara T, Watanabe K, Tamai K, Friboulet L, Katayama K, Ma B, Sasakura Y, Sagae Y, Kukimoto-Niino M, Shirouzu M, Takagi S, Simizu S, Nishio M, Okuno Y, Fujita N, *Katayama R.? Gilteritinib overcomes lorlatinib resistance in ALK-rearranged cancer. Nature Commun. 2021 Feb 24;12(1):1261. doi: 10.1038/s41467-021-21396-w.
- Furuta H, Araki M, Masago K, Sagae Y, Fujita S, Seto K, Shimizu J, Horio Y, Sasaki E, Hosoda W, Katayama R, Okuno Y, Hida T. Novel resistance mechanisms including L1196Q, P1094H, and R1248_D1249insertion in three patients with non-small-cell lung cancer following ALK tyrosine kinase inhibitor treatment. J Thorac Oncol. 2021 Mar;16(3):477-482. doi: 10.1016/j.jtho.2020.09.023.
- Ariyasu R, Yanagitani N, Tadokoro K, Yamaguchi T, Uchibori K, Kitazono S, Fujita N, *Katayama R, *Nishio M. Efficacy of EGFR tyrosine kinase inhibitors in patients having EGFR-activating mutations with or without BIM polymorphisms. Cancer Chemother Pharmacol. 2020 Oct;86(4):517-525. doi: 10.1007/s00280-020-04136-7.
- Papadopoulos KP, Borazanci E, Shaw AT, Katayama R, Shimizu Y, Zhu VW, Sun TY, Wakelee HA, Madison R, Schrock AB, Senaldi G, Nakao N, Hanzawa H, Masaya T, Isoyama T, Nakamaru K, Deng C, Li M, Fran F, Zhao Q, Gao Y, Seto T, Janne PA, Ou SI. US phase 1 first-in-human study of taletrectinib (DS-6051b/AB-106), a ROS1/TRK inhibitor, in patients with advanced solid tumors. Clin Cancer Res. 2020 Sep 15;26(18):4785-4794. Jun 26; doi: 10.1158/1078-0432.CCR-20-1630.
- Ono F, Chiba S, Isaka Y, Matsumoto S, Ma B, Katayama R, Araki M, Okuno Y. Improvement in predicting drug sensitivity changes associated with protein mutations using a molecular dynamics based alchemical mutation method. Sci Rep. 2020 Feb 7;10(1):2161.
- Arai S, Takeuchi S, Fukuda K, Taniguchi H, Nishiyama A, Tanimoto A, Satouchi M, Yamashita K, Ohtsubo K, Nanjo S, Kumagai T, Katayama R, Nishio M, Zheng MM, Wu YL, Nishihara H, Yamamoto T, Nakada M, Yano S. Osimertinib Overcomes Alectinib Resistance Caused by Amphiregulin in a Leptomeningeal Carcinomatosis Model of ALK-Rearranged Lung Cancer. J Thorac Oncol. 2020 Jan 21. pii: S1556-0864(20)30022-8.
- Yanagitani N, Uchibori K, Koike S, Tsukahara M, Kitazono S, Yoshizawa T, Horiike A, Ohyanagi F, Tambo Y, Nishikawa S, Fujita N, *Katayama R, *Nishio M. Drug resistance mechanisms in Japanese anaplastic lymphoma kinase-positive non-small cell lung cancer and the clinical responses based on the resistant mechanisms. Cancer Sci. 2020 Mar;111(3):932-939.
- Takahashi K, Seto Y, Okada K, Uematsu S, Uchibori K, Tsukahara M, Oh-Hara T, Fujita N, Yanagitani N, Nishio M, Okubo K, *Katayama R. Overcoming resistance by ALK compound mutation (I1171S + G1269A) after sequential treatment of multiple ALK inhibitors in non-small cell lung cancer. Thorac Cancer. 2020 Mar;11(3):581-587.
- *Katayama R, Gong B, Togashi N, Miyamoto M, Kiga M, Iwasaki S, Kamai Y, Tominaga Y, Takeda Y, Kagoshima Y, Shimizu Y, Seto Y, Oh-hara T, Koike S, Nakao N, Hanzawa H, Watanabe K, Yoda S, Yanagitani N, Hata A, Shaw AT, Nishio M, Fujita N, Isoyama T. The new-generation selective ROS1/NTRK Inhibitor DS-6051b overcomes crizotinib resistant ROS1-G2032R mutation in preclinical models. Nature Commun.2019; Aug 9;10(1):3604.
- Fukuda K, Takeuchi S, Arai S, Katayama R, Nanjo S, Tanimoto A, Nishiyama A, Nakagawa T, Taniguchi H, Suzuki T, Yamada T, Nishihara H, Ninomiya H, Ishikawa Y, Baba S, Takeuchi K, Horiike A, Yanagitani N, Nishio M, Yano S. Epithelial-to-mesenchymal transition is a mechanism of ALK inhibitor resistance in lung cancer independent of ALK mutation status. Cancer Res. 2019; 79:1658-1670. doi: 10.1158/0008-5472.CAN-18-2052
- Okada K, Araki M, Sakashita T, Ma B., Kanada R, Yanagitani N, Horiike A, Koike S, Oh-Hara T, Watanabe K, Tamai K, Maemondo M, Nishio M, Ishikawa T, Okuno Y, Fujita N, *Katayama R Prediction of ALK mutations mediating ALK-TKIs resistance and drug re-purposing to overcome the resistance. EBioMedicine, 2019; 41:105-119, doi: 10.1016/j.ebiom.2019.01.019
- Gong B, Oh-Hara T, Fujita N, *Katayama R. 3D culture system containing gellan gum restores oncogene dependence in ROS1 rearrangements non-small cell lung cancer. Biochem Biophys Res Commun. 2018 Jun 22;501(2):527-533. doi:10.1016/j.bbrc.2018.05.031. Epub 2018 May 10. PubMed PMID: 29738763.
- Uchibori K, Inase N, Nishio M, Fujita N, *Katayama R. Identification of Mutation Accumulation as Resistance Mechanism Emerging in First-Line Osimertinib Treatment. J Thorac Oncol. 2018 Jul;13(7):915-925. doi: 10.1016/j.jtho.2018.04.005.PubMed PMID: 29702287.
- Ariyasu R, Nishikawa S, Uchibori K, Oh-Hara T, Yoshizawa T, Dotsu Y, Koyama J, Saiki M, Sonoda T, Kitazono S, Yanagitani N, Horiike A, Inase N, Kasahara K, Nishio M, *Katayama R. High ratio of T790M to EGFR activating mutations correlate with the osimertinib response in non-small-cell lung cancer. Lung Cancer. 2018 Mar;117:1-6. doi: 10.1016/j.lungcan.2017.12.018. Epub 2018 Jan 4. PubMed PMID: 29496249.
- *Katayama R. Drug resistance in anaplastic lymphoma kinase-rearranged lung cancer. Cancer Sci. 2018 Mar;109(3):572-580. doi: 10.1111/cas.13504. Epub 2018 Feb 15. Review. PubMed PMID: 29336091; PubMed Central PMCID: PMC5834792.
- Fuse MJ, Okada K, Oh-hara T, Ogura H, Fujita N, *Katayama R. Mechanisms of resistance to NTRK inhibitors and therapeutic strategies in NTRK1-rearranged cancers. Mol Cancer Ther. 2017, October 1;16? (10):2130-2143.
- Ogura H, Nagatake-Kobayashi Y. Adachi J, Tomonaga T, Fujita N, *Katayama R. TKI-addicted ROS1-rearranged cells are destined to survival or death by the intensity of ROS1 kinase activity. Scientific Reports. 2017, July 17; 7: 5519
- Uchibori K, Inase N, Araki M, Kamada M, Sato S, Okuno Y, Fujita N, *Katayama R. Brigatinib combined with anti-EGFR antibody overcomes osimertinib resistance in EGFR-mutated non-small-cell lung cancer. Nature Commun., 2017 Mar 13;8:14768. doi:10.1038/ncomms14768
- *Katayama R. Therapeutic strategies and mechanisms of drug resistance in anaplastic lymphoma kinase (ALK)-rearranged lung cancer. Pharmacol Ther. 2017 Sep;177:1-8. doi: 10.1016/j.pharmthera.2017.02.015. Epub 2017 Feb 7. Review., PMID: 28185914
- Gainor JF, Dardaei L, Yoda S, Friboulet L, Leshchiner I, Katayama R, Dagogo-Jack I, Gadgeel S, Schultz K, Singh M, Chin E, Parks M, Lee D, DiCecca RH, Lockerman E, Huynh T, Logan J, Ritterhouse LL, Le LP, Muniappan A, Digumarthy S, Channick C, Keyes C, Getz G, Dias-Santagata D, Heist RS, Lennerz J, Sequist LV, Benes CH, Iafrate AJ, Mino-Kenudson M, Engelman JA, *Shaw AT. Molecular Mechanisms of Resistance to First- and Second-Generation ALK Inhibitors in ALK-Rearranged Lung Cancer. Cancer Discov. 2016, 6(10):1118-1133.
- Shaw AT, Friboulet L, Leshchiner I, Gainor JF, Bergqvist S, Brooun A, Burke BJ, Deng YL, Liu W, Dardaei L, Frias RL, Schultz KR, Logan J, James LP, Smeal T, Timofeevski S, Katayama R, Iafrate AJ, Le L, McTigue M, Getz G, Johnson TW, *Engelman JA. Resensitization to Crizotinib by the Lorlatinib ALK Resistance Mutation L1198F. N Engl J Med. 2016 Jan 7;374(1):54-61.
- *Katayama R, Sakashita T, Yanagitani N, Ninomiya H, Horiike A, Friboulet L, Gainor JF, Motoi N, Dobashi A, Sakata S, Tambo Y, Kitazono S, Sato S, Koike S, John Iafrate A, Mino-Kenudson M, Ishikawa Y, Shaw AT, Engelman JA, Takeuchi K, *Nishio M, *Fujita N. P-glycoprotein Mediates Ceritinib Resistance in Anaplastic Lymphoma Kinase-rearranged Non-small Cell Lung Cancer. EBioMedicine, 2016 Jan; 3: 54?66.
- Zou HY, Friboulet L, Kodack DP, Engstrom LD, Li Q, West M, Tang RW, Wang H, Tsaparikos K, Wang J, Timofeevski S, Katayama R, Dinh DM, Lam H, Lam JL, Yamazaki S, Hu W, Patel B, Bezwada D, Frias RL, Lifshits E, Mahmood S, Gainor JF, Affolter T, Lappin PB, Gukasyan H, Lee N, Deng S, Jain RK, Johnson TW, Shaw AT, Fantin VR, *Smeal T. PF-06463922, an ALK/ROS1 Inhibitor, Overcomes Resistance to First and Second Generation ALK Inhibitors in Preclinical Models. Cancer Cell, 2015 Jul 13;28(1):70-81.
- *Katayama R, Lovly CM, Shaw AT. Therapeutic targeting of anaplastic lymphoma kinase in lung cancer: a paradigm for precision cancer medicine. Clin Cancer Res. 2015 May 15;21(10):2227-35. Review.
- Niederst MJ, Sequist LV, Poirier JT, Mermel CH, Lockerman EL, Garcia AR, Katayama R, Costa C, Ross KN, Moran T, Howe E, Fulton LE, Mulvey HE, Bernardo LA, Mohamoud F, Miyoshi N, VanderLaan PA, Costa DB, J?nne PA, Borger DR, Ramaswamy S,Shioda T, Iafrate AJ, Getz G, Rudin CM, Mino-Kenudson M, *Engelman JA. RB loss in resistant EGFR mutant lung adenocarcinomas that transform to small-cell lung cancer. Nature Commun. 2015 Mar 11;6:6377.
- Katayama R, Kobayashi Y, Friboulet L, Lockerman EL, Koike S, Shaw AT, Engelman JA, *Fujita N. Cabozantinib overcomes crizotinib resistance in ROS1 fusion-positive cancer. Clin Cancer Res. 2015 Jan 1;21(1):166-74.
- Crystal AS, Shaw AT, Sequist LV, Friboulet L, Niederst MJ, Lockerman EL, Frias RL, Gainor JF, Amzallag A, Greninger P, Lee D, Kalsy A, Gomez-Caraballo M, Elamine L, Howe E, Hur W, Lifshits E, Robinson HE, Katayama R, Faber AC, Awad MM, Ramaswamy S, Mino-Kenudson M, Iafrate AJ, Benes CH, *Engelman JA., Patient-derived models of acquired resistance can identify effective drug combinations for cancer. Science, 2014 Dec 19;346(6216):1480-6.
- Katayama R, Friboulet L, Koike S, Lockerman EL, Khan TM, Gainor JF, Iafrate AJ, Takeuchi K, Taiji M, Okuno Y, Fujita N, *Engelman JA, *Shaw AT. Two novel ALK mutations mediate acquired resistance to the next-generation ALK inhibitor alectinib. Clin Cancer Res.2014 Nov 15;20(22):5686-96.
- Friboulet L†, Li N†, Katayama R†, Lee CC, Gainor JF, Crystal AS, Michellys PY, Awad MM, Yanagitani N, Kim S, Pferdekamper AC, Li J, Kasibhatla S, Sun F, Sun X, Hua S, McNamara P, Mahmood S, Lockerman EL, Fujita N, Nishio M, Harris JL, Shaw AT, *Engelman JA. The ALK inhibitor ceritinib overcomes crizotinib resistance in non-small cell lung cancer. Cancer Discov. 2014 Jun;4(6):662-73. †: co-first authors