研究内容目次
ポリADP-リボシル化酵素タンキラーゼの機能と阻害剤
ポリADP-リボシル化酵素(PARP)を標的としたがん創薬
ポリADP-リボシル化(PAR化)は、タンパク質に最も大きな物性変化を与える翻訳後修飾の一つで、PARP[poly(ADP-ribose) polymerases]と呼ばれる一群の酵素によって触媒される生化学反応です。ゲノムの安定性や遺伝子転写制御をはじめ、様々な生物学的事象の調節に寄与することが知られています。
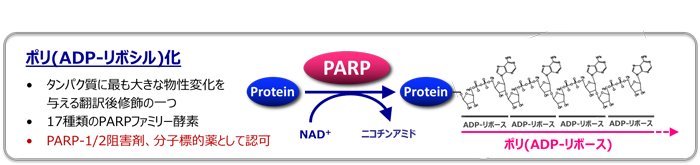
一方、ポリADP-リボース鎖の機能特異性を担保する分子メカニズムをはじめ、不明な点も多く残されています。PARPには遺伝子ファミリーが存在し、なかでもPARP-1およびPARP-2の酵素活性を阻害する薬剤(PARP阻害剤)は、がん抑制遺伝子BRCA1もしくはBRCA2などの相同組換え修復遺伝子を欠損したがんに有効であることから、欧米および日本でがん治療薬として認可されています。PARP-1/2阻害剤はDNAの1本鎖切断修復を阻害しますが、そのままの状態で細胞周期が進行すると、DNAの1本鎖切断は2本鎖切断に変換されます。通常の細胞は相同組換え修復機構を利用してこの損傷DNAを修復することができますが、BRCA1もしくはBRCA2などの相同組換え修復遺伝子を欠損したがん細胞では、これができないために致死となります。このように、がん抑制遺伝子の欠損とPARPの阻害という2つの要素が合わさって初めて細胞毒性が現れることを、合成致死(synthetic lethality)といいます。合成致死の原理を利用したPARP阻害剤の抗がん剤としての成功は、がん抑制遺伝子の「不在性」をターゲティングするという創薬概念を確立するとともに、創薬シーズとしてのPARPファミリー酵素の新たな可能性を提示するものでした。
タンキラーゼ〜さまざまながん形質を支えるPARP
私たちは、テロメラーゼのテロメア伸長機能を促進するタンキラーゼ(tankyrase)と呼ばれるPARPファミリーの5・6番目のメンバー(PARP-5a/b)に着目し、その制御機構とがん治療への応用について検討を進めています。発端となったのは、タンキラーゼが有するテロメア伸長作用でした。テロメアにはシェルタリンと呼ばれるタンパク質複合体が会合しており、その中核となるTRF1というタンパク質は、テロメラーゼのテロメアのアクセスを妨げています。タンキラーゼは、このTRF1をポリADP-リボシル化修飾することで、TRF1をテロメアから遊離させ、ユビキチン分解へと導きます。TRF1の結合が低下したテロメアにはテロメラーゼが近づきやすくなるため、テロメアの伸長が観察されるようになります。私たちは、タンキラーゼの働きを阻害することで、より多くのTRF1をテロメア上に滞留させ、テロメラーゼのアクセスを遮断することに成功しました。そして、この条件下でテロメラーゼ阻害剤を処理すると、がん細胞のテロメア短縮が加速し、より早期に細胞老化と細胞死が誘導されることを見出したのです。このような背景を踏まえ、私たちは選択性の高い新たなタンキラーゼ阻害剤を開発すべく、スクリーニング・評価体制を整備しました。
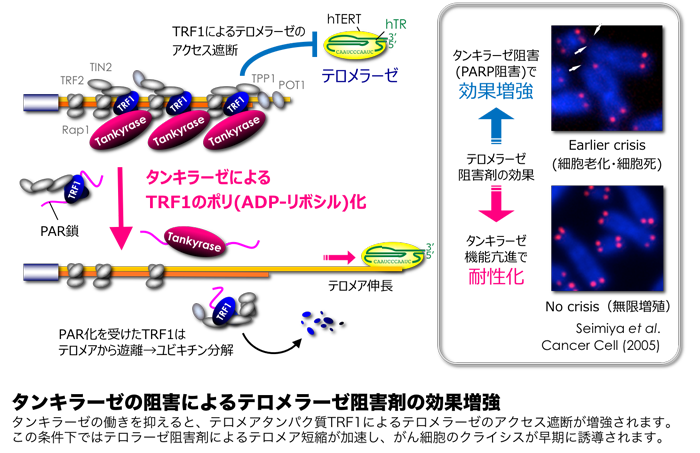
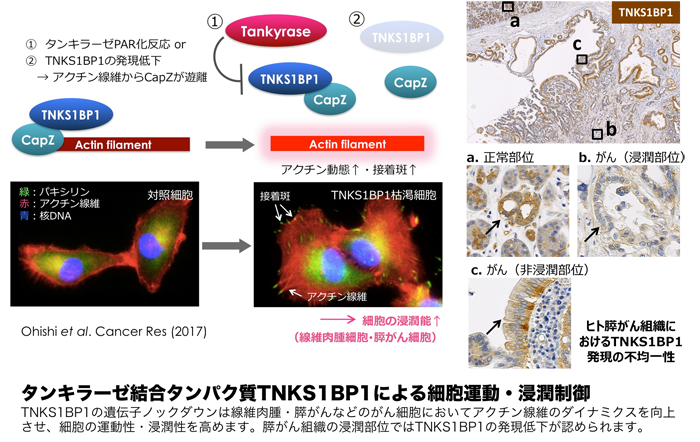
一方、私たちはタンキラーゼの構造を注意深く解析し、分子内ARC(ANK repeat cluster)ドメインとTRF1との結合やその機能的意義を明らかにしてきました。タンキラーゼは細胞内の様々な部位に局在し、ARCを介して多様なタンパク質と結合します。私たちは、TNKS1BP1やMERIT40といったタンキラーゼ結合タンパク質を単離し、これらのタンパク質との相互作用を介した細胞運動やDNA損傷修復の制御メカニズムを明らかにしてきました。
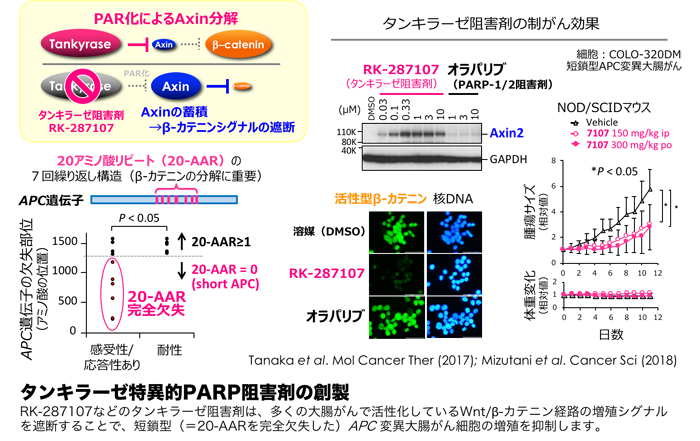
タンキラーゼ特異的PARP阻害剤の開発
タンキラーゼはWnt/β-カテニン経路と呼ばれるがん細胞増殖シグナルを強めることもわかっています。Wnt/β-カテニン経路は、大腸がんをはじめ、様々ながんで異常な活性化を認めていますが、治療薬をつくりにくい、いわゆる「non-druggable」な標的経路とされてきました。タンキラーゼは、β-カテニンの負の制御因子であるアキシンというタンパク質をポリ(ADP-リボシル)化し、これをユビキチン分解に導くことで、β-カテニンシグナルを支えています。私たちが創製したタンキラーゼ阻害剤RK-287107はこのβ-カテニンシグナルを遮断することで、大腸がんのゼノグラフト腫瘍(=免疫不全マウスに移植したヒトがん細胞由来の腫瘍)の増殖を抑えることを見出しました。ひとくちに大腸がんといっても様々であり、私たちは、どのようなゲノム変異をもったがんがタンキラーゼ阻害剤に対して感受性を示すのか、薬効予測が可能なバイオマーカーの探索研究も進めています。バイオマーカーの設定は、これからの精密医療(プレシジョン医療)の要衝となる重要な課題の一つであり、所内倫理審査委員会の承認のもと、がん研有明病院の患者さん由来の検体を使わせていただきながら、鋭意検討を進めています。