ALKキナーゼ・ROS1キナーゼ融合遺伝子陽性肺がんの、治療薬への耐性化機構と克服薬を発見することに成功
ポイント
- ALK融合遺伝子陽性肺がんの、ALK阻害薬Alectinibへの耐性機構として新たに2つのALK遺伝子の変異を発見し、スーパーコンピューター「京」を用いた立体構造シミュレーションで確認しました。
- 上記のAlectinib耐性変異を克服する薬剤として、米国において2014年に承認されたCeritinibが有効であることを同定しました。
- ROS1融合遺伝子陽性肺がんのROS1/ALK阻害薬Crizotinibへの耐性機構として新たに2つのROS1遺伝子の変異を発見しました。
- 上記のCrizotinib耐性変異を克服する薬剤として、米国において甲状腺がんへの使用が承認されているCabozantinibが有効であることを同定しました。
論文名、著者およびその所属
論文1
- 論文名
Two novel ALK mutations mediate acquired resistance to the next generation ALK inhibitor alectinib - ジャーナル名
Clinical Cancer Research - 著者
Ryohei Katayama1, Luc Friboulet5, Sumie Koike1, Elizabeth L. Lockerman5, Tahsin M. Khan5, Justin F. Gainor5, A. John Iafrate5, Kengo Takeuchi2, Makoto Taiji3, Yasushi Okuno4, Naoya Fujita1*, Jeffrey A. Engelman5*, Alice T. Shaw5*
* 責任著者(藤田直也、Jeffrey A. Engelman、Alice T. Shaw) - 著者の所属機関
1. がん研究会 がん化学療法センター 基礎研究部
2. がん研究会 がん研究所 分子標的病理プロジェクト
3. 理化学研究所 計算科学研究機構 プロセッサ研究チーム
4. 京都大学 医学部
5. マサチューセッツ総合病院 がんセンター
- この論文はEditor’s choiceに選ばれ、また下記の論文でも紹介されました。
Perfect ALKemy: Optimizing the Use of ALK-Directed Therapies in Lung Cancer
論文2
- 論文名
Cabozantinib overcomes crizotinib resistance in ROS1 fusion positive cancer - ジャーナル名
Clinical Cancer Research - 著者
Ryohei Katayama1, Yuka Kobayashi1, Luc Friboulet2, Elizabeth L. Lockerman2, Sumie Koike1, Alice T. Shaw2, Jeffrey A. Engelman2, and Naoya Fujita1*
* 責任著者(藤田直也) - 著者の所属機関
1. がん研究会 がん化学療法センター 基礎研究部
2. マサチューセッツ総合病院 がんセンター
論文概要
論文1
片山量平研究員(がん研究会 がん化学療法センター 基礎研究部)と 藤田直也部長(がん研究会 がん化学療法センター 基礎研究部)、竹内賢吾プロジェクトリーダー(がん研究会 がん研究所 分子標的病理プロジェクト)及び京都大学医学部、理化学研究所計算科学研究機構 プロセッサ研究チーム、マサチューセッツ総合病院がんセンターの研究グループは、ALK融合遺伝子陽性肺がんに対する第2世代ALK阻害薬Alectinibに対する耐性を引き起こす変異を新たに同定し、さらにその耐性に対してCeritinibが有効であることを見出しました。
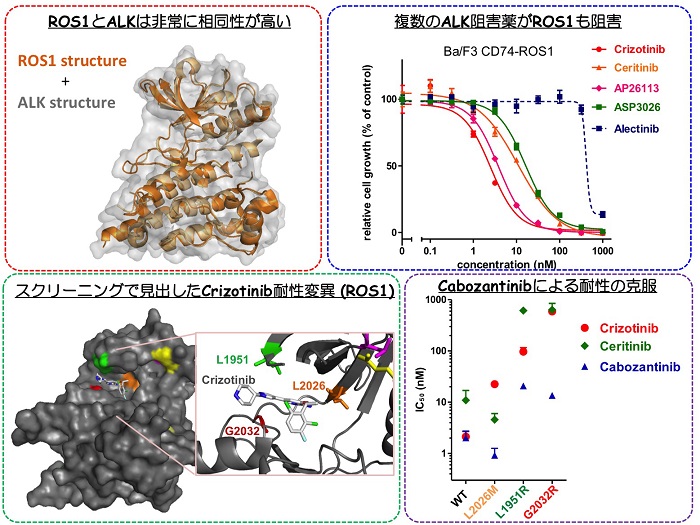
がんは我が国の主たる死亡原因の疾患であり、生涯の間に国民の2人に1人が、がんに罹患するとされています。なかでも肺がんはがんの中で最も死亡者が多く、年間7万人以上の方が肺がんで命を落とされており、より効果的な治療法の開発が切望されています。遠隔転移や浸潤などのある進行肺がんでは、外科手術による治療が困難な場合が多く、薬物療法や放射線療法が中心となっています。薬物療法としては近年までは細胞障害性の抗がん剤による化学療法が中心でしたが、この約10年の間にEGFRチロシンキナーゼ阻害薬(ゲフィチニブやエルロチニブなど)の登場と、EGFR活性化型変異の発見を契機に、肺がんの領域においても分子標的薬の有用性が高まってきております。さらに2007年には、間野博士らのグループにより肺がんにおける強力ながん遺伝子としてALK融合遺伝子が発見され、非小細胞肺がん(肺がん全体の約8割を占める)の3〜5%の症例(日本人で推定2000症例/年)がALK融合遺伝子陽性肺がんであることが明らかになってきています。このALK融合遺伝子陽性肺がんに対して行われたALK阻害薬クリゾチニブの臨床試験の結果では、ALK融合陽性肺がんにおいて約65%の奏効率と8〜10か月の無増悪生存期間という高い効果が認められており、2012年には本邦においても承認され実臨床で使用されています。しかしながらクリゾチニブによる治療を始めてから1年〜数年程度するとほとんどのケースにおいて治療抵抗性を獲得した耐性腫瘍が出現することが大きな問題となっています。この耐性がどのようなメカニズムで生じるのかを明らかにし、耐性を克服できる特異的治療法の発見が、より効果的な薬物療法の発展にとって重要であると考えられ、現在盛んに研究が進められており、これまでに、片山研究員らを含む世界中の様々なグループからクリゾチニブへの耐性のメカニズムが報告されています。最も高頻度に見られるクリゾチニブ耐性機構としては、ALKのチロシンキナーゼ領域のATP結合ポケットに存在する1196番目のロイシン(L)がメチオニン(M)に代わるゲートキーパーと呼ばれる耐性変異があり、他にも様々なタイプのALKキナーゼ領域の変異が報告されている。これらのクリゾチニブ耐性変異型ALKにも有効な薬剤として、様々な第2世代ALK阻害薬が開発されており、中でもAlectinibは臨床試験の結果非常に良好な腫瘍縮小効果が認められており、この7月に本邦で世界に先駆けて承認されたALK阻害薬です。AlectinibはL1196Mゲートキーパー変異や他のクリゾチニブ耐性変異(G1269Aなど)にも有効であることが示されており、期待されている薬剤の1つです。しかしながら、Alectinibに対しても数年すると耐性が生じ再発してしまうことが明らかになってきつつあります。近年米国より1例報告されたAlectinib耐性症例ではALKキナーゼ領域内のG1202R変異が見出されております。この変異は、EGFR-TKIの耐性の際には見られなかったsolvent front と呼ばれる薬剤結合部位の入り口の耐性変異であり、Crizotinib耐性症例で最初に見いだされたCrizotinib耐性変異でもあります(Katayama R. et al, Science Transl Med. 2012)。さらに、2014年4月に米国で承認されている第2世代ALK阻害薬Ceritinibに対し耐性となった腫瘍を我々とMGHのグループで共同研究を行い検索した結果、10例中3例からこのG1202RをCeritinib耐性変異として発見し、報告しています (Friboulet L and Katayama R et al., Cancer Discov. 2014)。つまりこのG1202R変異は第1世代ALK阻害薬Crizotinibおよび第2世代ALK阻害薬Alectinib, Ceritinibいずれに対しても耐性を起こしてしまう変異です。
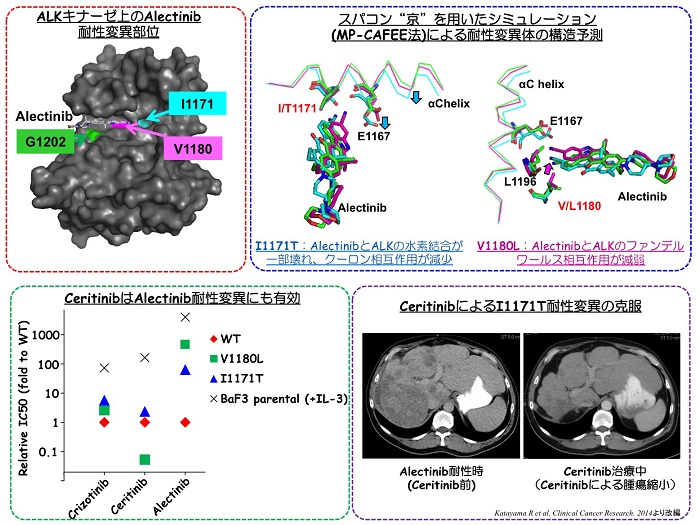
本研究では、Alectinib耐性機構を明らかにするために培養細胞を用いてAlectinib耐性細胞を作成し、その耐性機構について検討し、新規Alectinib耐性機構としてV1180L変異を同定しました。さらに、MGHがんセンターと共同研究し、Alectinib治療後に耐性となった症例から新たな耐性変異I1171Tを同定しました。これらの変異型EML4-ALKはいずれもAlectinibに強い耐性を示しただけでなく、Crizotinibにも耐性を示すことが明らかとなりました。次にこれらの変異がどのようにしてAlectinib耐性を引き起こすかを構造学的に明らかにするために京都大学大学院医学研究科奥野恭史教授および理化学研究所泰地真弘人博士らの研究グループとの共同研究により、スーパーコンピューター京を用いたAlectinibとALKキナーゼ(野生型および変異型)との結合をシミュレーションすることで結合エネルギーを算出しました。その結果、V1180L変異ではALKキナーゼとAlectinibの間のファンデルワールス相互作用が減少し、I1171T変異ではクーロン相互作用が減少することでAlectinibとALKの結合親和性が低下する(=Alectinibの阻害活性が弱まっている)ことが示唆されました。
そこで次にこれらのAlectinib耐性変異に対し有効な阻害薬を探索したところ、CeritinibおよびAP26113がV1180LとI1171Tの両方の変異体に対して有効であることを見出しまし。I1171T変異が見つかったAlectinib耐性患者の肝生検検体から樹立した細胞株は確かにCeritinibに高い感受性を示し、さらに、この患者はAlectinibの後の治療としてCeritinibの臨床試験において治療がなされましたが、CeritinibによりI1171T変異の見つかった部位である肝転移巣の劇的な腫瘍縮小が認められ、その後7か月の間奏功が認めらました。
Alectinibは2014年7月に本邦でALK陽性肺がんに対するALK阻害薬として承認され、わが国においてはCrizotinibに次いで2剤目となる臨床で使用可能なALK阻害薬です。Crizotinib耐性のGatekeeperなどの変異にも有効として期待される一方で、やはりAlectinibに対しても耐性が生じることが明らかとなってきました。ALK陽性肺がんでは本研究を含め様々な耐性変異が見出されてきておりそれぞれの耐性変異によって、各ALK阻害薬の感受性が異なることから、ALK阻害薬をSequentialに利用する治療法も今後の治療戦略として期待されます。また、本研究で用いた構造シミュレーションでは、ALKキナーゼと変異体と阻害薬の結合エネルギーの計算結果が実験結果と非常によく相関していたことから、今後、シミュレーションから耐性変異の予測や、有効な阻害薬のin silicoスクリーニングが期待できます。しかし、スーパーコンピューター京を用いてもなお、1つの変異体と阻害薬との分子動力学計算に非常に長い計算時間がかかることから、さらなる高性能な計算機の開発とともにシミュレーション方法の改良が期待されます。また、本研究で見出された2つの耐性変異についてはCeritinibやAP26113が有効である可能性が本研究から示唆される一方で、G1202R変異のようにCrizotinib, Alectinib, Ceritinibいずれにも耐性を有する変異体に対しては、今後有効な薬剤の発見が必須です。さらに、ALK融合遺伝子上の耐性変異以外の機構による耐性についてのメカニズムのさらなる解明とその克服のための治療戦略を明らかにすることが今後重要です。
論文2
片山量平研究員(がん研究会 がん化学療法センター 基礎研究部)と 藤田直也部長(がん研究会 がん化学療法センター 基礎研究部)、及びマサチューセッツ総合病院(MGH)がんセンターの研究グループは、ROS1融合遺伝子陽性肺がんに対するROS1/ALK阻害薬Crizotinibに対する耐性を引き起こす変異を新たに同定し、さらにそれらの耐性変異に対して現在米国で甲状腺がんに承認されており、本邦においても臨床試験が進行中のCabozantinibが有効であることを発見しました。
肺がんにおけるROS1融合遺伝子は2007年に肺がん細胞株において初めて発見され、2012年には当会竹内賢吾博士(がん研究所 分子標的病理プロジェクト プロジェクトリーダー)らにより様々なROS1融合遺伝子が肺がん患者検体から発見されています(Takeuchi K. et al, Nature Medicine. 2012)。ROS1融合遺伝子は、肺腺がんの約1%に見られる非常に稀な変異であり、これまでの研究からALK融合遺伝子陽性肺がんと同様に、肺がん患者の平均年齢に比べて10歳程度若いことが示されています。ROS1の活性領域であるチロシンキナーゼドメインはALKチロシンキナーゼドメインと相同性が非常に高く、これまでにALK阻害薬CrizotinibがROS1のチロシンキナーゼ活性も強力に阻害することが明らかとなっており、ROS1陽性肺がん患者を対象とした臨床試験が進められております。最近、第I 相試験の結果が報告されており、奏効率72%、無増悪生存期間の中央値19.2か月と非常に良好な結果が報告されました (Shaw AT. et al, NEJM 2014)。しかしながらやはり治療抵抗性を獲得した耐性腫瘍が出現することが明らかとなってきており、その耐性機構の解明と克服法の発見が課題です。片山研究員らはMGHがんセンターにおいてこれまでにCrizotinib耐性となったROS1融合遺伝子陽性肺がん患者1症例の検体を用いてその耐性機構を調べ、ROS1キナーゼ領域内のG2032R変異がCrizotinib耐性を誘導することを見出し報告しています(Awad MM, Katayama R et al, NEJM 2013)。片山らはこの研究の中でG2032R変異を有するROS1融合遺伝子陽性肺がん細胞株を樹立することに成功しています。このG2032R変異はALKのG1202R変異と相同的な位置に存在するsolvent front変異であり、G2032R変異型ROS1にも有効な薬剤の登場が切望されていました。
本研究で我々は、まずマウスpro-B細胞由来IL-3依存性Ba/F3細胞にCD74-ROS1を発現させ、IL-3非依存的に生存するBa/F3_CD74-ROS1細胞を構築し、各種ALK阻害薬の有効性を評価しました。その結果、Alectinibを除くいずれのALK阻害薬(Crizotinib, Ceritinib, AP26113, ASP3026)もBa/F3-CD74-ROS1細胞の増殖を強く阻害しました。次に、ROS1阻害活性が見られたALK阻害剤の中で、すでに臨床でALK陽性肺がん治療に利用されているCrizotinibとCeritinibに耐性となるROS1の遺伝子変異を予測するために、DNAアルキル化剤であるENU(N-ethyl N-nitrosourea)を用いてランダムに変異をBa/F3-CD74-ROS1に導入し、CrizotinibまたはCeritinibで薬剤セレクションを行いました。その結果、実際に患者で見つかっていたG2032Rの変異に加えて、新たにL1951RおよびL2026M変異を同定しました。L2026M変異はゲートキーパー部位の変異であり、Crizotinibには耐性を有するものの、Ceritinibには感受性でした。これに対し、L1951R変異はG2032Rと立体的には近接したSolvent front変異であり、いずれのALK阻害薬にもG2032R同様耐性を示しました。
次に、G2032R耐性変異にも有効な薬剤を見いだすために、化学療法基盤支援活動 標準阻害薬キットに、治験薬・承認されているキナーゼ阻害薬を加えた約300の薬剤を用いてHigh Throughputスクリーニングを行いました。その結果、新たにROS1を阻害する薬剤を複数同定し、その中でもCabozantinibは野生型およびG2032R耐性変異の両方を低濃度で阻害することを見出しました。さらに、Cabozantinibは他のCrizotinib耐性変異体に対しても低濃度で阻害活性を示しました。またMGHにおいて患者検体より樹立したG2032R変異型CD74-ROS1を有する細胞株に対してもCrizotinibやCeritinibに比べ低濃度で増殖を抑制し、ROS1の活性化の指標であるリン酸化も低濃度で抑制しました。本研究から、Crizotinib耐性変異ROS1に対し、Cabozantinibが有効であることが強く示唆されました。今後実験動物を用いたin vivoでのCabozantinibの効果の検討等が必要ですが、そのうえでの臨床応用が期待されます。