胃がんの新規抗がん物質を同定―ゴルジ体を標的とした新しい治療法開発へ道−
ポイント
- M-COPA(2-メチルコプロフィリンアミド[AMF-26])は、がん研究会がん化学療法センターが以前見出し、その後東京理科大学が人工合成に成功した新規ゴルジ体阻害剤であり、一部のがん細胞に強力な抗がん活性を示すことが知られていました。
- がん研究会がん化学療法センター分子薬理部の旦(だん)慎吾副部長、大橋愛美主任研究助手、東京理科大学理学部第一部応用化学科・椎名勇教授、ならびに、エーザイ株式会社の共同研究チームは、今回、METと呼ばれるHGF(ヒト肝細胞増殖因子)に対する受容体型チロシンキナーゼ(RTK)を発現する難治性胃がん(MET陽性胃がん)に対して、M-COPAが抗がん効果を発揮することを明らかにしました。
- METタンパク質は、ゴルジ体によりプロセッシングされ、細胞膜表面に輸送されますが、M-COPA投与によりMETタンパク質のプロセッシングや細胞表面への輸送が阻害され、ゴルジ体阻害の概念実証(POC)が確立されました。
- 本剤は、MET陽性胃がんだけでなく、FGFR2(線維芽細胞増殖因子受容体2)と呼ばれるRTKを発現する別の難治性胃がんに対しても同様な機序で抗がん効果を示しました。
- 本研究成果により、チロシンキナーゼ阻害剤やモノクローナル抗体薬とは異なる、RTK依存がんの新たな治療アプローチとして、ゴルジ体阻害剤開発の加速化が期待されます。
- 本研究成果は、米国のがん研究専門誌「Cancer Research」に4月12日付でオンラインファーストにて未編集原稿が先行公開されました。
概要
がん研究会がん化学療法センター分子薬理部の旦(だん)慎吾副部長、大橋愛美主任研究助手、ならびに東京理科大学理学部第一部応用化学科・椎名勇教授、エーザイ株式会社の共同研究チームは、同チームが以前人工合成に成功した新規ゴルジ体阻害物質M-COPAを用いて、進行胃がんの予後不良因子として知られるMET陽性胃がんの治療実験に成功し、ゴルジ体阻害物質が難治性胃がんに対する新規抗がん剤として応用できる可能性を世界で初めて明らかにしました。
研究の背景と経緯
ゴルジ体は、DNAに刻まれた遺伝情報が転写・翻訳されて合成された新生タンパク質が、プロセシングや糖鎖修飾を受け、細胞膜上や細胞外に輸送される過程を制御する細胞内器官です。ゴルジ体機能を阻害するブレフェルジン Aは、試験管内でがん細胞の増殖を抑制することが知られています。私たちはこれまでに、天然のカビ由来の半合成化合物であるM-COPA(2-メチルコプロフィリンアミド[AMF-26])がブレフェルジンAと同様にゴルジ体構造を破壊すること、試験管内だけでなく動物を用いた治療実験で本剤が抗がん効果を示すことを明らかにしてきました(Ohashi Y et al, J Biol Chem, 2012)。また、M-COPAの人工合成に成功し、人工M-COPAが天然由来のものと同等のゴルジ阻害活性、抗がん作用を示すことを明らかにし、本剤を起点としたゴルジ体標的薬というユニークなメカニズムを有する新規抗がん剤の創薬研究が可能となりました(Shiina I et al, J Med Chem, 2013)。しかし、本剤がどのようながんに奏功するかはまだわかっていませんでした。
胃がんは、がんによる死亡のうち世界で3番目、日本では2番目に多いがん種であり、切除不能な進行胃がんに対する効果的な治療法の開発が求められています。近年発表されたThe Cancer Genome Atlas (TCGA)研究ネットワークの分類法よると、胃がんのおよそ50%は染色体不安定性型に属し、その多くは、METやHER2、FGFR2といった受容体型チロシンキナーゼ(RTK)が遺伝子増幅していること、その過剰発現が腫瘍増殖の原因になり、とりわけMET発現胃がんは予後不良であることが報告されていました(TCGA Research Network, Nature, 2014)。このことから、MET増幅胃がんに対する有効な治療法の開発は急務でした。
研究の内容
METなどのRTKはがん細胞の表面に発現していることから、M-COPAによりゴルジ体機能を阻害することによりMETの表面発現を抑制することができれば、本剤がMETを過剰発現する胃がんの治療に応用可能であると考えました。そこで本研究では、胃がん細胞株のうちMET遺伝子を増幅する3細胞株と、MET、HER2などのRTKを増幅していない3細胞株を用いて、細胞増殖に対するM-COPAの感受性を調べました。その結果、本剤は、MET増幅胃がん細胞で10倍程度良好な感受性を示すことがわかりました。その際、METたんぱく質のプロセシングが阻害されるとともに、細胞表面における発現が顕著に抑制され、METの自己リン酸化および下流のシグナル伝達分子の脱リン酸化が認められました。MET陽性胃がん細胞株であるMKN-45をヌードマウスの皮下に移植し、M-COPAによる治療実験を行ったところ、腫瘍増殖を有意に抑制しました。また、M-COPAによる選択的な抗がん作用は、FGFR2を発現する難治性のスキルス胃がん細胞株でも同様に認められました。以上のことから、本研究によりMETやFGFR2などのRTKを遺伝子増幅する胃がんの治療標的として、ゴルジ体が有望である可能性が世界で初めて示されました。
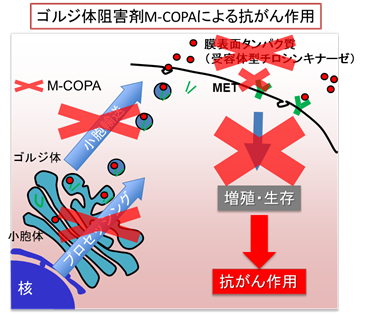
【研究のインパクト及び今後の展開】
進行・再発胃がんの薬物治療は、TS-1、白金製剤、タキサンを用いた化学療法が中心であり、決して満足できる治療成績ではありません。HER2陽性胃がんでハーセプチン併用療法が用いられているものの、HER2以外のRTK陽性胃がんでは使うことができません。本研究成果により、予後不良なMET陽性胃がん、FGFR2陽性胃がんに対して、ゴルジ体阻害剤によりRTKの細胞表面発現阻害を介した治療法が実現されたら、RTKの酵素活性を抑制するチロシンキナーゼ阻害剤や、ハーセプチンのような抗体薬とは異なる、RTK依存がんの新たな治療アプローチとして注目されます。また、胃がん以外にも、EGFR遺伝子変異肺がんなど様々ながん種のRTK依存に対する治療オプションとしての可能性も期待され、今後の研究開発の進展が期待されます。
【文献】
M-COPA, a Golgi disruptor, inhibits cell surface expression of MET protein and exhibits antitumor activity against MET-addicted gastric cancers
Cancer Res., Published OnlineFirst April 12, 2016; doi: 10.1158/0008-5472.CAN-15-2220
Yoshimi Ohashi1, Mutsumi Okamura1, Asaka Hirosawa1, Naomi Tamaki1, Akinobu Akatsuka1, Kuo-Ming Wu2, Hyeong-Wook Choi2, Kentaro Yoshimatsu3, Isamu Shiina4, Takao Yamori1, Shingo Dan1*.
- (公財)がん研究会 がん化学療法センター分子薬理部
- エーザイ・インク アンドーバー研究所(米国)
- エーザイ株式会社
- 東京理科大学理学部第一部応用化学科
* 責任著者
【その他の参考文献】
- Ohashi Y, Iijima H, Yamaotsu N, Yamazaki K, Sato S, Okamura M, Sugimoto K, Dan S, Hirono S, Yamori T. AMF-26, a novel inhibitor of the Golgi system, targeting ADP-ribosylation factor 1 (Arf1) with potential for cancer therapy. J Biol Chem. 2012 Feb 3;287(6):3885-97.
- Shiina I, Umezaki Y, Ohashi Y, Yamazaki Y, Dan S, Yamori T. Total synthesis of AMF-26, an antitumor agent for inhibition of the Golgi system, targeting ADP-ribosylation factor 1. J Med Chem. 2013 Jan 10;56(1):150-9.
- Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014 Sep 11;513(7517):202-9.