- HOME
- がん化学療法センターについて
- 所長室
- 遺伝子治療研究室
室長:杉本芳一(併任)
慶應義塾大学薬学部 化学療法学講座 教授
がんに対する化学療法においては、2つの大きな課題がある。ひとつはがん細胞が抗がん剤に抵抗性(耐性)を示すことであり、これには治療の始めから抗がん剤が効かない自然耐性と、治療を続けていくうちに最初は有効であった抗がん剤が効かなくなってしまう獲得耐性がある。もうひとつの課題は抗がん剤が骨髄などの正常細胞に強い毒性を示すことである。これらはともにがん細胞あるいは正常細胞の抗がん剤感受性・耐性によって決定される。我々の研究室では、細胞を抗がん剤耐性とする因子のなかで、特にABCトランスポーターと呼ばれる細胞膜タンパク質ファミリーに注目して研究を進めてきた。ヒトのABCトランスポーターのうち、P-糖タンパク質(ABCB1、MDR1遺伝子産物)、MRP1(ABCC1)、BCRP(ABCG2)などは、種々の抗がん剤をエネルギー依存的に細胞外に排出する。このためこれらのトランスポーターを発現するがん細胞は抗がん剤に耐性を示す。また、正常組織におけるトランスポーターの活性の低下は、抗がん剤への体外への排出を遅延させて抗がん剤の毒性を増強させる。したがってがん細胞と正常組織におけるこれらのトランスポーターの発現は、抗がん剤に対するがんの自然耐性と獲得耐性、および抗がん剤の正常細胞に対する毒性を左右する重要な要因である。我々の研究室では従来、抗がん剤耐性のメカニズムの研究、抗がん剤耐性の克服法の研究、耐性遺伝子の遺伝子多型と薬物動態に関する研究などを進めてきた。そして、こうした研究の成果を基盤とした遺伝子治療臨床研究として、「抗がん剤耐性遺伝子をがん患者の正常骨髄細胞に導入することによりがん化学療法における骨髄抑制を軽減させる耐性遺伝子治療の臨床研究」を、有明病院化学療法科と共同で推進している。
研究課題
耐性遺伝子治療の臨床研究
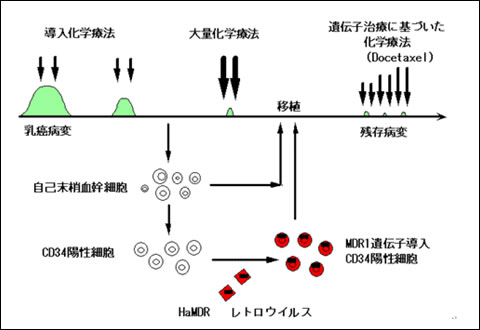
抗がん剤耐性遺伝子をがん患者の正常骨髄細胞に導入することにより、がん化学療法における骨髄抑制を軽減させる耐性遺伝子治療の臨床研究
MDR1遺伝子は細胞膜に発現するP-糖タンパク質をコードする遺伝子である。P-糖タンパク質は種々の天然物由来の抗がん剤をATP依存的に細胞外に排出するポンプとして働く。MDR1遺伝子導入によりP-糖タンパク質を発現する細胞はvinca alkaloid、anthracycline、taxaneなどの抗がん剤に耐性を示す。したがって、がん患者より採取した正常造血幹細胞にMDR1遺伝子を導入して患者に戻し移植して患者の正常骨髄細胞を抗がん剤耐性とすることで、その後の抗がん剤投与時における骨髄抑制が回避できると考えられる。一方、臨床の進行乳がんに対する自己造血幹細胞移植併用大量化学療法は最も強力な治療で、CR(完全寛解)への導入率は高い。しかし移植後の骨髄機能は概して不十分であり、その後の化学療法が困難で、そのために微小残存病変・再発がんに対する有効な治療法が存在しない。がん研における耐性遺伝子治療は、進行再発乳がん患者より採取したCD34陽性細胞に多剤耐性遺伝子MDR1を導入して患者に移植することにより、大量化学療法後のdocetaxelなどによる地固め療法・維持療法における骨髄抑制を軽減させ、治療を安全に遂行する。これによりがんの再発を遅らせ、生存期間の延長を目指す。これまでに3人の患者さんが本治療を受けた。最初の2人の患者さんは2001年にMDR1遺伝子導入細胞の移植を受けた。移植後の患者末梢血にはMDR1遺伝子導入細胞・P-糖タンパク質陽性細胞が検出された。その後のdocetaxel治療によりP-糖タンパク質陽性細胞の割合は増加し、MDR1遺伝子導入細胞が体内で抗がん剤耐性細胞として機能したことが推定された。一連の化学療法により患者さんの乳がん転移病変は完全に消失し、その後3年半〜5年半、再発のない状態が続いた。3人目の患者さんは、2004年にMDR1遺伝子導入細胞の移植を受けた。MDR1遺伝子導入細胞の異常増殖などの有害事象は認められていない。以上の結果は本臨床研究の安全性と臨床的有用性を示唆するものと考える。
- Mitsuhashi J, Tsukahara S, Suzuki R, Oh-hara Y, Nishi S, Hosoyama H, Katayama K, Noguchi K, Minowa S, Shibata H, Ito Y, Hatake K, Aiba K, Takahashi S, Sugimoto Y. Retroviral integration site analysis and the fate of transduced clones in an MDR1 gene therapy protocol targeting metastatic breast cancer. Hum Gene Ther (2007) 18: 895-906.
- Sugimoto Y, Tsukahara S, Sato S, Suzuki M, Nunoi H, Malech HL, Gottesman MM, Tsuruo T. (2003) Drug-selected co-expression of P-glycoprotein and gp91 in vivo from an MDR1-bicistronic retrovirus vector Ha-MDR-IRES-gp91. J Gene Med 5: 366-376.