- HOME
- 新着情報
【ニュースリリース】稀少な大腸神経内分泌細胞がんにおける薬剤耐性機構の発見 〜BRAFスプライシングバリアントによるBRAF阻害薬耐性機構〜
2022年06月22日
1.ポイント
・BRAF変異陽性の大腸神経内分泌細胞がん (Neuroendocrine carcinoma : NEC)の患者由来細胞株を樹立し、BRAF阻害薬 (Dabrafenib)に対する耐性機構を探索し、BRAFスプライシングバリアントが関与していることを実験レベルで明らかにしました。
・BRAFスプライシングバリアントを介したBRAF阻害薬への耐性を克服するにはBRAFからの増殖シグナル下流の因子であるMEKやERKに対する阻害薬が有効である可能性を実験的に示しました。
2.研究の概要
大腸がんのわずか0.6%と極めて稀な疾患として、神経内分泌細胞がん(NEC)(注1)が存在します。この大腸のNECは低分化型で予後不良であることに加え、一般的な大腸がんと比較して、BRAF遺伝子変異(注2)を有している割合が高いことが知られています。このBRAF遺伝子変異は、悪性黒色腫や肺がん、大腸がんなど、様々ながん種でドライバーがん遺伝子として見つかり、変異型BRAFを標的とした分子標的薬が複数開発されてきました。しかし、悪性黒色腫や肺がんと異なり、BRAF遺伝子変異陽性大腸がんでは活性化BRAFに対する分子標的薬(BRAF阻害薬:注3)のみでは十分な有効性が得られにくいことから複数の分子標的薬との併用療法が実臨床で使用されています。一方で、BRAF変異を持つ大腸のNEC(CRC-NECと以後表記)ではBRAF阻害薬単独でも有効性が得られることが報告されています。しかし、他の分子標的薬と同様にBRAF変異陽性CRC-NECにおいてもBRAF阻害薬に対する獲得耐性の出現が問題となってきています。この問題を解決するためには、どのようなメカニズムが耐性に寄与するのかを明らかにし、その耐性克服法を見出す必要があります。
がん研究会の片山量平(がん研究会 がん化学療法センター 基礎研究部 部長)、清水裕貴、丸山航平(同研究部所属、東京大学大学院新領域創成科学研究科博士課程 大学院生)らの研究グループは、BRAF変異陽性CRC-NEC患者の手術検体より樹立したがん細胞株を用いて、BRAF阻害薬耐性CRC-NEC細胞株を樹立し、その耐性機構を探索しました。詳細な解析によって耐性細胞ではBRAFスプライシングバリアントが発現し、そのバリアントがBRAF阻害薬に抵抗性を誘導することを発見しました。そしてBRAFスプライシングバリアントによる耐性は、BRAFからの増殖シグナル下流の因子であるMEKやERKに対する阻害薬が有効である可能性を実験的に明らかにしました。
本研究から、BRAF変異CRC-NEC におけるBRAF阻害薬耐性機構の1つとしてBRAFスプライシングバリアントの発現を見出し、その耐性はMEK阻害薬やERK阻害薬により克服できる可能性を基礎研究レベルで明らかにしました。
3.論文名、著者およびその所属
○論文名: Acquired resistance to BRAF inhibitors is mediated by BRAF splicing variants in BRAF V600E mutation-positive colorectal neuroendocrine carcinoma.
○ジャーナル名
Cancer Letters
○著者
Yuki Shimizua,b,1, Kohei Maruyamaa,b,1, Mai Suzukia,b, Hiroshi Kawachic,d, Siew-Kee Lowe, Tomoko Oh-haraa, Kengo Takeuchic,d,f, Naoya Fujitag, Satoshi Nagayamah,i, Ryohei Katayamaa,b,*
(*責任著者、1. 共筆頭著者)
○著者の所属機関
a. 公益財団法人がん研究会 がん化学療法センター 基礎研究部
b. 東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻
c. 公益財団法人がん研究会 がん研有明病院 病理部
d. 公益財団法人がん研究会 がん研究所 病理部
e. 公益財団法人がん研究会 がんプレシジョン医療研究センター
f. 公益財団法人がん研究会 がん研究所 分子標的病理プロジェクト
g. 公益財団法人がん研究会 がん化学療法センター
h. 公益財団法人がん研究会 がん研有明病院 大腸外科
i. 宇治徳洲会病院 消化器外科
4.研究の詳細
背景
大腸がんの約0.6%に存在している大腸神経内分泌がん (CRC-NEC)*1は低分化型で悪性度が高く、予後不良であることが知られています。また、興味深い特徴としてBRAF遺伝子変異*2の陽性率が通常の大腸がんよりも高いことが挙げられます。通常のBRAF変異陽性大腸がんにおける薬物療法では、BRAF特異的な阻害薬 (BRAF阻害薬*3)単独では有効性が得られにくいため、複数の分子標的薬を組み合わせた併用療法が用いられますが、BRAF変異陽性CRC-NECではBRAF阻害薬単独でも有効性が得られるという報告が海外からなされています。しかしながらBRAF阻害薬を含め、分子標的薬を用いた際には治療過程で獲得耐性が出現し、がんが再発してしまうことが問題となっています。また、BRAF変異CRC-NECにおけるBRAF阻害薬耐性メカニズムやその克服法に関する知見はほとんど明らかではありませんでした。そこで本研究グループは、独自に患者検体から樹立したBRAF変異CRC-NEC細胞株を用いてBRAF阻害薬耐性機構と克服法の探索を行うこととしました。
研究内容
はじめに、がん研究会の倫理審査委員会承認済みのプロトコールに則り同意の得られたBRAF変異陽性CRC-NEC患者の手術残余組織片から患者由来細胞株 (PDC)の樹立を行いました。樹立したCRC-NECのPDCは、先行論文でも報告されている通り、BRAF阻害薬に高い感受性を示しました。BRAF変異CRC-NECのBRAF阻害薬に対する耐性機構を探索するため、このPDCにBRAF阻害薬を比較的高濃度で長期間処理することでBRAF阻害薬耐性細胞株を樹立しました。
次に、BRAF阻害薬耐性メカニズムを明らかにするためBRAF下流のシグナル経路の活性化や、がん関連遺伝子変異解析等を行いました。その結果、耐性細胞株ではBRAF阻害薬存在下でもBRAF下流の増殖シグナルであるMAPK経路*4が活性化されたままであること、他のがん関連遺伝子には変異等がないことが判りました。そこで、BRAF遺伝子自体に異常がないかを調べるためPCR法を用いてBRAF遺伝子の増幅と増幅産物のシーケンス解析を行なったところ、全長型より短いBRAFスプライシングバリンアント*5が少なくとも3種類発現していることを発見しました。次に、一過的に変異型BRAFスプライシングバリアントを発現させた細胞を作製しBRAF阻害薬の感受性を評価しました。その結果、BRAFスプライシングバリアントが導入された細胞株では、BRAF阻害薬に耐性を示しました。また、発見したBRAFスプライシングバリアントは全長型のBRAFと二量体を形成し、MAPK経路を活性化することも明らかになりました。
そこで、BRAFスプライシングバリアントを介したBRAF阻害薬細胞にも有効な阻害薬を探索するため独自に調整した阻害剤ライブラリーを用いてスクリーニングを行いました。その結果、MAPK経路を構成するMEK阻害薬、ERK阻害薬に高い感受性を示すことが確認されました。
本研究から、BRAF変異CRC-NECにおいて、初めて変異型BRAFスプライシングバリアントがBRAF阻害薬耐性に関与する可能性を基礎研究レベルで示し、MEK阻害薬やERK阻害薬による耐性克服の可能性について報告しました。
5.本研究への支援
本研究は、下記機関より資金的支援等を受けて実施されました。
・国立研究開発法人 日本医療研究開発機構(AMED) 次世代がん医療加速化研究事業(P-PROMOTE)「iPS 細胞技術を応用した創薬スクリーニングによる希少難治性がん治療戦略の開発」ほか
・日本学術振興会 科学研究費
・内藤記念科学振興財団 研究助成
・公益財団法人 日本財団
6.用語解説
(*1) 大腸神経内分泌細胞がん (CRC-NEC)
神経内分泌細胞がん(NEC)は神経内分泌腫瘍 (NEN)の分類の1つであり、低分化型で比較的増殖が速く、予後不良であることが知られています。本研究ではNECの中でも大腸に発生した大腸神経内分泌細胞がん(CRC-NEC)を研究対象としました。
(*2) BRAF変異
MAPK経路を構成する因子であるRAFのアイソフォームの1つ。悪性黒色腫や大腸がん、肺がんをはじめとする様々ながん種でBRAF遺伝子異常が報告されています。中でも、600番目のバリンがグルタミン酸に置き換わる突然変異 (BRAF V600E変異)は強力にがん化を誘導することが知られています。
(*3) BRAF阻害薬
BRAF遺伝子変異タンパク質のキナーゼ活性を抑制する分子標的薬。本邦においては、ダブラフェニブ、ベムラフェニブ、エンコラフェニブが承認されており、BRAF変異大腸がんでは主にエンコラフェニブが用いられています。
(*4) MAPK経路
受容体型チロシンキナーゼ等からシグナルが伝達されることで活性化される細胞内シグナル経路の1つとして知られています。主に細胞の分化や増殖を正に制御している経路であり、この経路を構成するRAS/RAF/MEKに遺伝子変異が起こると過剰な増殖シグナル伝達によりがん化が引き起こされます。
(*5) スプライシングバリアント
真核生物の細胞内では、ゲノムDNAからタンパク質が作られるまでに転写、翻訳という過程を挟みます。転写過程ではDNAから遺伝情報を読み取り、RNAが合成されます。この段階では、ゲノム上のタンパク質情報を含むエクソン領域と含まないイントロン領域の両方がmRNA前駆体としてコピーされます。mRNAの成熟過程では、イントロン領域を除去するスプライシングを経てエクソン領域のみが残るmRNAが合成されます。このスプライシングに異常が起こると様々なバリアント体が出現し、様々な疾患にも関与することが知られています。
・BRAF変異陽性の大腸神経内分泌細胞がん (Neuroendocrine carcinoma : NEC)の患者由来細胞株を樹立し、BRAF阻害薬 (Dabrafenib)に対する耐性機構を探索し、BRAFスプライシングバリアントが関与していることを実験レベルで明らかにしました。
・BRAFスプライシングバリアントを介したBRAF阻害薬への耐性を克服するにはBRAFからの増殖シグナル下流の因子であるMEKやERKに対する阻害薬が有効である可能性を実験的に示しました。
2.研究の概要
大腸がんのわずか0.6%と極めて稀な疾患として、神経内分泌細胞がん(NEC)(注1)が存在します。この大腸のNECは低分化型で予後不良であることに加え、一般的な大腸がんと比較して、BRAF遺伝子変異(注2)を有している割合が高いことが知られています。このBRAF遺伝子変異は、悪性黒色腫や肺がん、大腸がんなど、様々ながん種でドライバーがん遺伝子として見つかり、変異型BRAFを標的とした分子標的薬が複数開発されてきました。しかし、悪性黒色腫や肺がんと異なり、BRAF遺伝子変異陽性大腸がんでは活性化BRAFに対する分子標的薬(BRAF阻害薬:注3)のみでは十分な有効性が得られにくいことから複数の分子標的薬との併用療法が実臨床で使用されています。一方で、BRAF変異を持つ大腸のNEC(CRC-NECと以後表記)ではBRAF阻害薬単独でも有効性が得られることが報告されています。しかし、他の分子標的薬と同様にBRAF変異陽性CRC-NECにおいてもBRAF阻害薬に対する獲得耐性の出現が問題となってきています。この問題を解決するためには、どのようなメカニズムが耐性に寄与するのかを明らかにし、その耐性克服法を見出す必要があります。
がん研究会の片山量平(がん研究会 がん化学療法センター 基礎研究部 部長)、清水裕貴、丸山航平(同研究部所属、東京大学大学院新領域創成科学研究科博士課程 大学院生)らの研究グループは、BRAF変異陽性CRC-NEC患者の手術検体より樹立したがん細胞株を用いて、BRAF阻害薬耐性CRC-NEC細胞株を樹立し、その耐性機構を探索しました。詳細な解析によって耐性細胞ではBRAFスプライシングバリアントが発現し、そのバリアントがBRAF阻害薬に抵抗性を誘導することを発見しました。そしてBRAFスプライシングバリアントによる耐性は、BRAFからの増殖シグナル下流の因子であるMEKやERKに対する阻害薬が有効である可能性を実験的に明らかにしました。
本研究から、BRAF変異CRC-NEC におけるBRAF阻害薬耐性機構の1つとしてBRAFスプライシングバリアントの発現を見出し、その耐性はMEK阻害薬やERK阻害薬により克服できる可能性を基礎研究レベルで明らかにしました。
3.論文名、著者およびその所属
○論文名: Acquired resistance to BRAF inhibitors is mediated by BRAF splicing variants in BRAF V600E mutation-positive colorectal neuroendocrine carcinoma.
○ジャーナル名
Cancer Letters
○著者
Yuki Shimizua,b,1, Kohei Maruyamaa,b,1, Mai Suzukia,b, Hiroshi Kawachic,d, Siew-Kee Lowe, Tomoko Oh-haraa, Kengo Takeuchic,d,f, Naoya Fujitag, Satoshi Nagayamah,i, Ryohei Katayamaa,b,*
(*責任著者、1. 共筆頭著者)
○著者の所属機関
a. 公益財団法人がん研究会 がん化学療法センター 基礎研究部
b. 東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻
c. 公益財団法人がん研究会 がん研有明病院 病理部
d. 公益財団法人がん研究会 がん研究所 病理部
e. 公益財団法人がん研究会 がんプレシジョン医療研究センター
f. 公益財団法人がん研究会 がん研究所 分子標的病理プロジェクト
g. 公益財団法人がん研究会 がん化学療法センター
h. 公益財団法人がん研究会 がん研有明病院 大腸外科
i. 宇治徳洲会病院 消化器外科
4.研究の詳細
背景
大腸がんの約0.6%に存在している大腸神経内分泌がん (CRC-NEC)*1は低分化型で悪性度が高く、予後不良であることが知られています。また、興味深い特徴としてBRAF遺伝子変異*2の陽性率が通常の大腸がんよりも高いことが挙げられます。通常のBRAF変異陽性大腸がんにおける薬物療法では、BRAF特異的な阻害薬 (BRAF阻害薬*3)単独では有効性が得られにくいため、複数の分子標的薬を組み合わせた併用療法が用いられますが、BRAF変異陽性CRC-NECではBRAF阻害薬単独でも有効性が得られるという報告が海外からなされています。しかしながらBRAF阻害薬を含め、分子標的薬を用いた際には治療過程で獲得耐性が出現し、がんが再発してしまうことが問題となっています。また、BRAF変異CRC-NECにおけるBRAF阻害薬耐性メカニズムやその克服法に関する知見はほとんど明らかではありませんでした。そこで本研究グループは、独自に患者検体から樹立したBRAF変異CRC-NEC細胞株を用いてBRAF阻害薬耐性機構と克服法の探索を行うこととしました。
研究内容
はじめに、がん研究会の倫理審査委員会承認済みのプロトコールに則り同意の得られたBRAF変異陽性CRC-NEC患者の手術残余組織片から患者由来細胞株 (PDC)の樹立を行いました。樹立したCRC-NECのPDCは、先行論文でも報告されている通り、BRAF阻害薬に高い感受性を示しました。BRAF変異CRC-NECのBRAF阻害薬に対する耐性機構を探索するため、このPDCにBRAF阻害薬を比較的高濃度で長期間処理することでBRAF阻害薬耐性細胞株を樹立しました。
次に、BRAF阻害薬耐性メカニズムを明らかにするためBRAF下流のシグナル経路の活性化や、がん関連遺伝子変異解析等を行いました。その結果、耐性細胞株ではBRAF阻害薬存在下でもBRAF下流の増殖シグナルであるMAPK経路*4が活性化されたままであること、他のがん関連遺伝子には変異等がないことが判りました。そこで、BRAF遺伝子自体に異常がないかを調べるためPCR法を用いてBRAF遺伝子の増幅と増幅産物のシーケンス解析を行なったところ、全長型より短いBRAFスプライシングバリンアント*5が少なくとも3種類発現していることを発見しました。次に、一過的に変異型BRAFスプライシングバリアントを発現させた細胞を作製しBRAF阻害薬の感受性を評価しました。その結果、BRAFスプライシングバリアントが導入された細胞株では、BRAF阻害薬に耐性を示しました。また、発見したBRAFスプライシングバリアントは全長型のBRAFと二量体を形成し、MAPK経路を活性化することも明らかになりました。
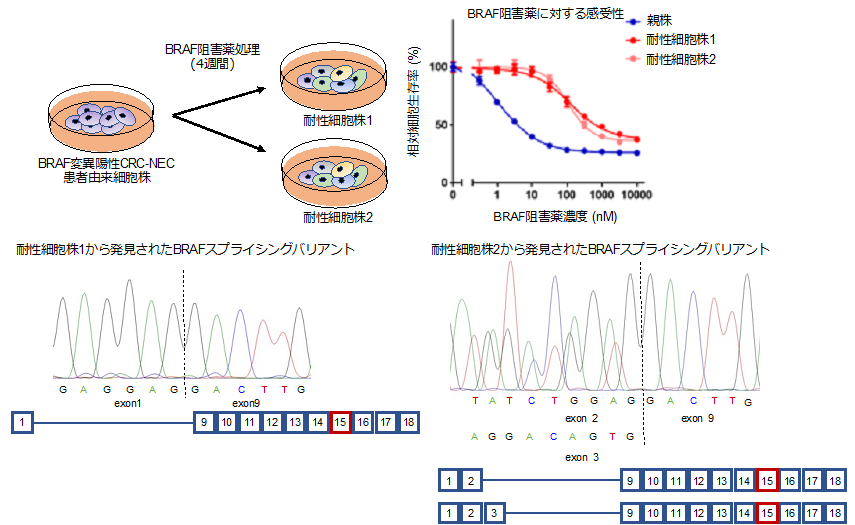
図 1 .BRAF阻害薬耐性細胞株の樹立と、耐性細胞から検出されたBRAFスプライシングバリアント
そこで、BRAFスプライシングバリアントを介したBRAF阻害薬細胞にも有効な阻害薬を探索するため独自に調整した阻害剤ライブラリーを用いてスクリーニングを行いました。その結果、MAPK経路を構成するMEK阻害薬、ERK阻害薬に高い感受性を示すことが確認されました。
本研究から、BRAF変異CRC-NECにおいて、初めて変異型BRAFスプライシングバリアントがBRAF阻害薬耐性に関与する可能性を基礎研究レベルで示し、MEK阻害薬やERK阻害薬による耐性克服の可能性について報告しました。
5.本研究への支援
本研究は、下記機関より資金的支援等を受けて実施されました。
・国立研究開発法人 日本医療研究開発機構(AMED) 次世代がん医療加速化研究事業(P-PROMOTE)「iPS 細胞技術を応用した創薬スクリーニングによる希少難治性がん治療戦略の開発」ほか
・日本学術振興会 科学研究費
・内藤記念科学振興財団 研究助成
・公益財団法人 日本財団
6.用語解説
(*1) 大腸神経内分泌細胞がん (CRC-NEC)
神経内分泌細胞がん(NEC)は神経内分泌腫瘍 (NEN)の分類の1つであり、低分化型で比較的増殖が速く、予後不良であることが知られています。本研究ではNECの中でも大腸に発生した大腸神経内分泌細胞がん(CRC-NEC)を研究対象としました。
(*2) BRAF変異
MAPK経路を構成する因子であるRAFのアイソフォームの1つ。悪性黒色腫や大腸がん、肺がんをはじめとする様々ながん種でBRAF遺伝子異常が報告されています。中でも、600番目のバリンがグルタミン酸に置き換わる突然変異 (BRAF V600E変異)は強力にがん化を誘導することが知られています。
(*3) BRAF阻害薬
BRAF遺伝子変異タンパク質のキナーゼ活性を抑制する分子標的薬。本邦においては、ダブラフェニブ、ベムラフェニブ、エンコラフェニブが承認されており、BRAF変異大腸がんでは主にエンコラフェニブが用いられています。
(*4) MAPK経路
受容体型チロシンキナーゼ等からシグナルが伝達されることで活性化される細胞内シグナル経路の1つとして知られています。主に細胞の分化や増殖を正に制御している経路であり、この経路を構成するRAS/RAF/MEKに遺伝子変異が起こると過剰な増殖シグナル伝達によりがん化が引き起こされます。
(*5) スプライシングバリアント
真核生物の細胞内では、ゲノムDNAからタンパク質が作られるまでに転写、翻訳という過程を挟みます。転写過程ではDNAから遺伝情報を読み取り、RNAが合成されます。この段階では、ゲノム上のタンパク質情報を含むエクソン領域と含まないイントロン領域の両方がmRNA前駆体としてコピーされます。mRNAの成熟過程では、イントロン領域を除去するスプライシングを経てエクソン領域のみが残るmRNAが合成されます。このスプライシングに異常が起こると様々なバリアント体が出現し、様々な疾患にも関与することが知られています。