c-MET阻害剤Tivantinibの新たな標的分子の同定
Cytotoxic activity of Tivantinib (ARQ 197) is not due solely to c-MET inhibition
Ryohei Katayama, Aki Aoyama, Takao Yamori, Jie Qi, Tomoko Oh-hara, Youngchul Song, Jeffrey A. Engelman and Naoya Fujita.
Cancer Research, in press
従来のがん化学療法は、DNA合成を阻害したり細胞の分裂機構を阻害したりすることで細胞増殖阻害作用を発揮するものが主流でした。増殖する細胞に共通した機構をターゲットとすることから脱毛、貧血症、消化管障害などの副作用が起こるという問題があります。そこで近年、よりがん細胞に特異的な分子をターゲットとした、分子標的治療法の開発が世界中で行われています。例えば、一部の肺がんでは、EGFR(上皮成長因子受容体)と呼ばれるチロシンキナーゼ遺伝子の恒常的な活性化を引き起こす変異が知られており、その変異を有する肺がんに対しては、ゲフィチニブ(イレッサ®)やエルロチニブ(タルセバ®)といったEGFRチロシンキナーゼ阻害剤(EGFR-TKI)とよばれる分子標的薬がきわめて有効であり、腫瘍の顕著な縮小がみられます。
c-METは肝細胞増殖因子(HGF)をリガンドとする受容体型チロシンキナーゼをコードするがん遺伝子であり、HGF/c-METシグナルの活性化は細胞の増殖、生存、運動性を増加させることで腫瘍形成に関与していると考えられています。c-MET遺伝子の増幅、活性化変異、HGF刺激などにより引き起こされるHGF/c-METパスウェイの異常な活性化は胃癌や肝癌を含む様々な腫瘍で確認されており、c-MET増幅の細胞株ではc-MET阻害剤に対して高い感受性を示すことが報告されています。更に、HGF/c-MET経路はEGFRチロシンキナーゼ阻害剤(EGFR-TKI)に対する獲得耐性機構に関与していることも知られており、c-METを介した獲得耐性については、EGFR-TKIに加えてc-MET阻害剤を併用することで耐性が克服されることが報告されています。これらの知見からc-METはがん治療における有望な分子標的と期待されており、阻害剤の開発が世界中で進められています。
Tivantinibは選択性が高く、経口投与可能なATP非競合的c-MET阻害剤として開発され、現在臨床試験が進んでいる低分子化合物です。しかし様々な腫瘍細胞をTivantinib存在下で培養した場合、従来のc-MET阻害剤に感受性を示さないc-MET非増幅のKRAS変異細胞株H460、A549で、c-MET増幅のMKN45細胞と同程度の増殖阻害活性を示すことが報告されています。このことからTivantinibによる増殖阻害活性はc-MET阻害以外の要因も関与する可能性が考えられたため、Tivantinibのc-METに対しての効果を再評価すると共に、他の分子標的を同定することを目的として研究を行いました。
まず、Tivantinibの増殖阻害活性がc-MET阻害に依存するかを確認するためにshRNAによるc-METの発現を抑制する実験(ノックダウン)で大幅な増殖阻害が見られたc-MET依存性の細胞(EBC-1、MKN45、SNU-638)と、ノックダウンしてもほとんど増殖が阻害されなかったc-MET非依存性の細胞(A549、H460、HCC827)を用意しました。Tivantinib、c-MET阻害剤として知られるPHA-665752及びcrizotinibに対する感受性を比較した結果、PHA-665752及びcrizotinibではc-MET依存性の細胞が非依存性の細胞に比べ極めて高い感受性を示したのに対し、Tivantinibはどちらの細胞にも同程度の薬剤濃度で細胞増殖阻害活性を示しました。このことから、Tivantinibはc-MET阻害以外の作用機序により細胞増殖阻害を引き起こしている可能性が考えられました。
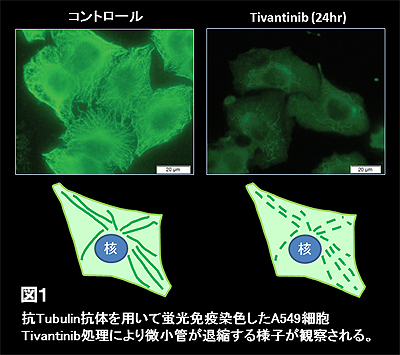 そこでTivantinibの真の分子標的を予測するために、がん研究会がん化学療法センター分子薬理部 矢守隆夫 博士らの開発したJFCR39の薬剤感受性に基づいたCOMPARE解析によるスクリーニングを行い、Tivantinibの増殖阻害プロファイルが既存の微小管阻害剤と類似したパターンを示すことを見出しました。Tivantinibが微小管阻害作用を示すか検討するため、微小管を構成するα-tubulinを免疫染色し細胞骨格の変化を観察した結果、微小管阻害剤として知られるvincristineと同様に、Tivantinib存在下で培養した細胞では、微小管の退縮が起こることを確認しました(図1)。
そこでTivantinibの真の分子標的を予測するために、がん研究会がん化学療法センター分子薬理部 矢守隆夫 博士らの開発したJFCR39の薬剤感受性に基づいたCOMPARE解析によるスクリーニングを行い、Tivantinibの増殖阻害プロファイルが既存の微小管阻害剤と類似したパターンを示すことを見出しました。Tivantinibが微小管阻害作用を示すか検討するため、微小管を構成するα-tubulinを免疫染色し細胞骨格の変化を観察した結果、微小管阻害剤として知られるvincristineと同様に、Tivantinib存在下で培養した細胞では、微小管の退縮が起こることを確認しました(図1)。
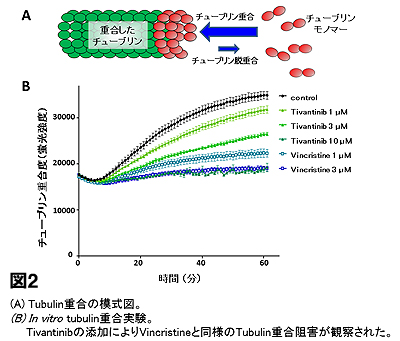 更に、精製tubulinを用いたin vitroでのtubulin 重合アッセイにより、Tivantinibがvincristineと同様にtubulin重合を濃度依存的に阻害することを確認しました(図2)。これらの結果から、tubulin 重合阻害による微小管形成の阻害がTivantinibの増殖阻害活性をもたらしている可能性を見出しました。
更に、精製tubulinを用いたin vitroでのtubulin 重合アッセイにより、Tivantinibがvincristineと同様にtubulin重合を濃度依存的に阻害することを確認しました(図2)。これらの結果から、tubulin 重合阻害による微小管形成の阻害がTivantinibの増殖阻害活性をもたらしている可能性を見出しました。
現在、Tivantinibの臨床試験はc-MET阻害剤であることを前提としてデザインされています。しかし、本研究からTivantinibの腫瘍細胞への増殖阻害活性は微小管阻害によるものと考えられることから、Tivantinibは他の固形がんにおいても良い治療成績を示す可能性があります。今後Tivantinibの作用機序を更に詳細に明らかにすることで、がん治療においてより適したTivantinibの臨床応用法が見つかる可能性が考えられます。