- HOME
- 注目の論文
【ニュースリリース】乳がんにおけるシス制御領域の多様性を単一細胞レベルで解明
〜がんの不均一性を理解するための基盤データリソースを構築〜
2025年12月1日
1. ポイント
- 乳がんの治療反応性や予後に大きなばらつきが見られる「臨床病理学的多様性」は、背景には遺伝子発現を制御するシス制御エレメント(CREs)の多様性が存在すると考えられていますが、がん組織の複雑な細胞構成と不均一性のため、これまでCREの網羅的な理解は困難でした。
- 本研究では高精度なクロマチンアクセシビリティ情報を取得し、網羅的な解析の結果、乳がん組織内のがん細胞や免疫・間質細胞において224,585個のCREを特定し、乳がん全体のシス制御ネットワークを構築しました。このネットワーク解析により、がんの多様性がCREレベルで規定されていることを初めて明確に示しました。
- 本研究は、乳がんのエピゲノム制御構造(DNAの塩基配列を変えずに遺伝子の働きを制御する仕組み)を単一細胞レベルで包括的に解析した大規模研究であり、がんの不均一性を理解するための基盤データリソースとして今後の研究に大きく貢献することが期待されます。将来的には、CREの異常を標的とする個別化エピゲノム治療の開発にもつながる可能性があります。
2. 研究の概要
乳がんは、世界的に最も患者数の多いがんの一つであり、治療反応性や予後に大きなばらつきが見られることが知られています。この「臨床病理学的多様性」は、単に遺伝子発現の違いだけでは説明できず、その背景には遺伝子発現を制御するシス制御エレメント(CREs)の多様性が存在すると考えられています。CREはエンハンサーやプロモーターなど、遺伝子のスイッチとして機能するDNA領域であり、その異常ががん細胞の性質を決定づける要因となります。しかし、がん組織の複雑な細胞構成と不均一性のため、これまでCREの網羅的な理解は困難でした。
公益財団法人がん研究会・NEXT-Gankenプログラムの研究チーム(上野 貴之 プログラムディレクター、丸山 玲緒 副プログラムディレクター、粂川 昂平 クリニカルリサーチフェロー、他)は、乳がんの臨床検体38例を対象に、単一細胞ATAC-seq(scATAC-seq)を用いてクロマチンアクセシビリティを網羅的に解析しました。22,775個の細胞から高精度なクロマチンアクセシビリティ情報を取得し、既存の単一細胞RNAシーケンスデータとの統合解析を通じて、がん細胞および腫瘍微小環境を高解像度でマッピングしました。
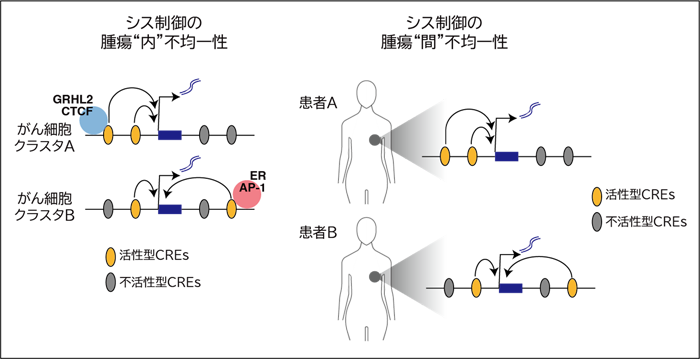
解析の結果、乳がん組織内のがん細胞や免疫・間質細胞において224,585個のCREを特定しました。さらに、細胞クラスターごとに特異的なCREを抽出し、これらがどの遺伝子に作用しているかを予測することで、乳がん全体のシス制御ネットワークを構築しました。このネットワーク解析により、同一遺伝子に作用するエンハンサー群の活性が腫瘍間および腫瘍内で異なることが明らかとなり、がんの多様性がCREレベルで規定されていることを初めて明確に示しました(図1)。
本研究は、乳がんのエピゲノム制御構造を単一細胞レベルで包括的に解析した大規模研究であり、がんの不均一性を理解するための基盤データリソースとして今後の研究に大きく貢献することが期待されます。将来的には、CREの異常を標的とする個別化エピゲノム治療の開発にもつながる可能性があります。
3. 論文名、著者および所属
◯論文名
Characterizing heterogeneous cis-regulatory elements in gene regulatory programs associated with breast cancer
◯掲載学術誌
Genome Medicine
DOI番号: 10.1186/s13073-025-01562-1
◯著者
Chisa Hori1,2,10, Kohei Kumegawa3,10*, Sumito Saeki1,4, Yoko Takahashi4, Liying Yang1, Tomoyoshi Nakadai1, Kazutaka Otsuji3, Chikako Takahata4, Yukinori Ozaki5, Natsue Uehiro4, Yurie Haruyama4, Tomo Osako6, Toshimi Takano5, Seiichi Mori7, Tetsuo Noda8, Satoshi Fujii2, Shinji Ohno9, Takayuki Ueno4, Reo Maruyama1,3*
◯著者の所属機関
- 公益財団法人がん研究会がん研究所・がんエピゲノム研究部
- 横浜市立大学大学院医学研究科・分子病理学
- 公益財団法人がん研究会NEXT-Gankenプログラム・がん細胞多様性解明プロジェクト
- 公益財団法人がん研究会有明病院・乳腺外科
- 公益財団法人がん研究会有明病院・乳腺内科
- 公益財団法人がん研究会がん研究所・病理部
- 公益財団法人がん研究会がんプレシジョン医療研究センター・がんゲノミクス研究部
- 公益財団法人がん研究会がん研究所・所長室
- 公益財団法人がん研究会有明病院・乳腺センター
- 共同筆頭著者
*責任著者
4. 本研究への支援
本研究は、公益財団法人がん研究会NEXT-Ganken事業及びNEXT-Ganken Plus事業、日本学術振興会(JSPS)科学研究費(JP20K07708、JP24K02312、JP24K18499、JP22K07161)、日本対がん協会、持田記念医学薬学振興財団、安田記念医学財団、車両競技公益資金記念財団等の資金的支援を受けて実施されました。
■がん研究会について
がん研究会は1908年に日本初のがん専門機関として発足して以来、100年以上にわたり日本のがん研究・がん医療において主導的な役割を果たしてきました。基礎的ながん研究を推進する「がん研究所」や、新薬開発やがんゲノム医療研究を推進する「がん化学療法センター」「がんプレシジョン医療研究センター」、さらに新しい医療の創造をする「がん研有明病院」を擁し、一体となってがんの克服を目指しています。
ウェブサイト: https://www.jfcr.or.jp/
関連PDF
- ニュースリリース文書
 (763KB )
(763KB )