研究内容目次
がん微小環境選択的な分子標的治療法の研究
(1)基本コンセプト
固形がんでは、血管形成不全のため、正常な組織にはみられない微小環境(低酸素やグルコース飢餓状態などのストレス環境)が存在します。このような微小環境は、がんの悪性化や薬剤耐性の原因となることが知られています。一方で、がんに特徴的であるため、治療のための良い標的として利用できると考えられています。実際、微小環境の特徴を積極的に利用しようという試みが活発に行われるようになってきています。例えば、血管形成に重要な内皮細胞や周皮細胞を標的とした血管新生阻害剤は、微小環境の特徴を利用した治療法の成功例であり、今では分子標的薬開発研究の主流の一つとなっています。 私たちは、がんに特徴的に認められる環境に注目し、「微小環境に立脚した生物学から創薬へ」をキャッチフレーズに、微小環境下におけるがん細胞の適応機構の基礎的研究を行うと共に、創薬に向けた開発研究を展開しています。
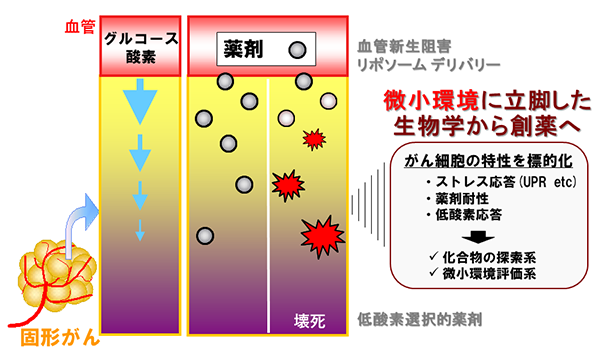
がん微小環境選択的な分子標的治療法の開発に向けて
がんに特徴的にみられる環境で、がん細胞がどのような適応戦略をとっているかを研究し、その適応メカニズムを標的とした治療法の開発を目指している。
(2)がん細胞のストレス応答に注目
私たちは、がん細胞自体を攻撃するため、低酸素やグルコース飢餓といった微小環境ストレスに対するがん細胞の適応応答(ストレス応答)に着目して研究を進めています。特に、小胞体に異常タンパク質が蓄積することによって活性化するUnfolded Protein Response (UPR)や代謝ストレスに対する適応機構において中心的な役割を果たしているIntegrated Stress Response (ISR)に注目しています。UPRやISRが活性化すると、がん細胞は低酸素やグルコース飢餓といった微小環境ストレス下でも生存できるようになります。それだけではなく、こうしたストレス適応機構の活性化したがん細胞は、既存の多くの抗がん剤に耐性化してしまうことも明らかになっています。そのため、微小環境ストレス下にあるがん細胞のストレス適応機構を制御することによって、治療効果が得られるのみならず、既存の抗がん剤の効果が増強されることも期待できます。 私たちは、UPRやISRを標的とした治療法開発の基盤を築くため、遺伝子発現解析技術を活用し、ストレス適応の制御機構の解明に取り組んでいます。
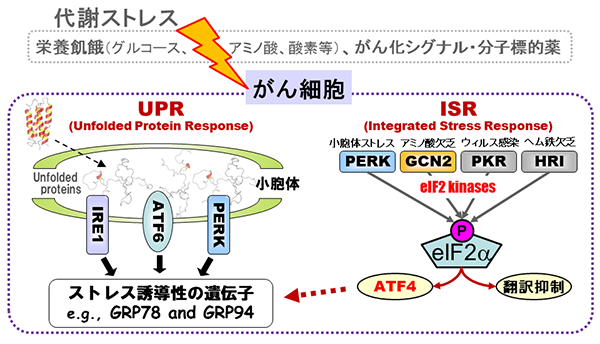
代表的なストレス適応機構
がん微小環境において、グルコース飢餓、アミノ酸欠乏、低酸素といった代謝ストレスに対して、がん細胞はUnfolded Protein Response (UPR)やIntegrated Stress Response (ISR)といったストレス応答シグナル経路を活性化し適応する。これらのストレス応答シグナル経路は、がん化シグナルや分子標的薬によっても活性化されることが知られており、新たな治療標的として期待されている。
(3)創薬に向けて
私たちは、上記の基礎研究による基盤情報を活用して、ストレス応答シグナルを阻害する化合物の探索やその作用機序解析の研究、さらには動物レベルでの薬効評価試験等の研究を行っています。こうした研究を通じ、新たな創薬コンセプトを確立することを目指しています。すでにversipelostatinなどの有望なUPR阻害剤を見出すことにも成功しております。私たちは、こうした有望な化合物については、がん組織への選択的な送達が可能なDrug Delivery System (DDS)と組み合わせることも考慮し、実用化に向けた研究に取り組んでいます。
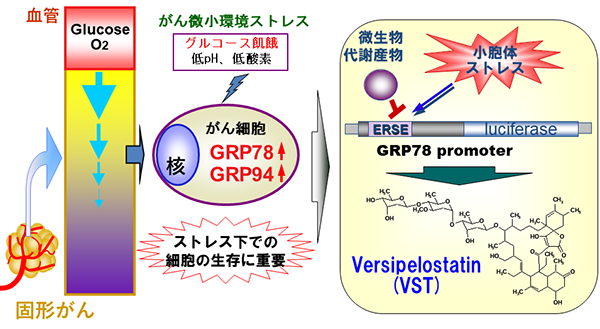
がん細胞の適応応答を標的化
血管から離れたがん細胞は、低酸素やグルコース飢餓などの微小環境ストレスにさらされる。こうした微小環境ストレス下では、がん細胞内ではUPRが活性化され、小胞体分子シャペロンGRP78やGRP94の誘導を促す。このUPRの活性化は、ストレス環境下でのがん細胞の生存に重要な役割を果たしている。抗腫瘍活性を有するversipelostatin (VST)はUPR抑制を指標に単離された。