【プレスリリース】がん研・理研発 タンキラーゼ阻害剤RK-582 大腸がん患者を対象に国内初の医師主導第Ⅰ相治験を開始
2025年05月08日
公益財団法人がん研究会(理事長:浅野 敏雄、以下 がん研究会)は、国立研究開発法人理化学研究所(理事長:五神 真、以下 理化学研究所)との共同研究により創薬したタンキラーゼ(注1)阻害剤RK-582の国内初となる医師主導治験において、2025年3月に、1例目の患者さんへの投与を、公益財団法人がん研究会有明病院(以下、がん研有明病院)にて実施しました。
本治験は、切除不能進行・再発大腸がん患者を対象に、RK-582の安全性および忍容性に加え、副次的に有効性を評価することを目的としております。本剤は、大腸がんの約 80%で見られるがん抑制遺伝子 APC の機能喪失型変異により亢進した Wnt/β-カテニンシグナル(注2)を遮断し(図1)、腫瘍組織の増殖を抑制することが非臨床のレベルで確認されています。今後は、投与症例の経過観察を通じて慎重に評価が進められます。
本治験は、上記研究機関がこれまでの非臨床の共同研究成果を、国立研究開発法人日本医療研究開発機構(AMED)の革新的がん医療実用化研究事業ならびに日本財団から研究開発費の支援を受け、基礎研究から臨床応用を実現したものです。RK-582の医師主導第Ⅰ相治験は、タンキラーゼ阻害剤として世界初の薬事承認取得を目指す試みであるとともに、新たな治療法を提供する重要な一歩と位置付けられます。
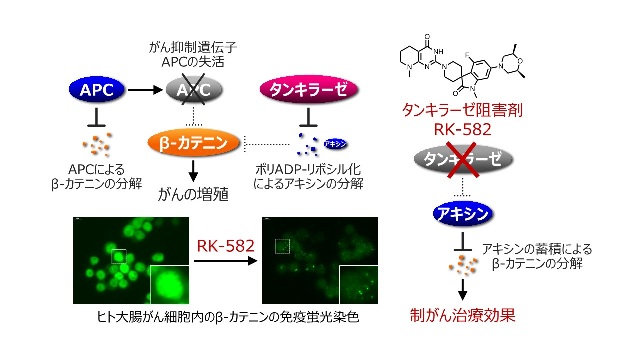
図1. タンキラーゼ阻害剤によるWnt/β-カテニンシグナルの遮断 大腸がんではがん抑制遺伝子APCが失活し、細胞増殖に寄与するβ-カテニンが蓄積しています。タンキラーゼはアキシンというタンパク質を分解に導くことでβ-カテニンを安定化します。培養細胞および実験動物を用いた検討により、RK-582はβ-カテニンの分解を誘導し、大腸がんの増殖を抑制することが実証されています。
1.研究開発の背景
我が国では年間15万人以上が大腸がんに罹患し、5万4千人が大腸がんで死亡しています。大腸がんは、早期であれば内視鏡治療や腹腔鏡下・開腹手術で対処可能であり、進行期においても、局所にとどまるがんや切除が可能な転移がんは治癒の可能性があります。しかし、切除不能進行・再発大腸がんは一般的に難治性であり、新薬の開発・提供が切望されています。
大腸がんの約80%は、がん抑制遺伝子APC の機能喪失型変異によりWnt/β-カテニンシグナルの亢進を示します。しかし、同経路には創薬展開が可能な標的分子が存在せず、このシグナルを遮断するがん治療薬の開発は困難とされてきました。ポリADP-リボシル化酵素(注3)ファミリーの一員であるタンキラーゼは、β-カテニンの抑制因子アキシンを分解に導くことでWnt/β-カテニンシグナルを増強します。このことから、タンキラーゼの阻害剤はアキシンの分解を阻害することでWnt/β-カテニンシグナルを抑制して、大腸がんの増殖などを抑える治療薬になる可能性があります。我々が創製したタンキラーゼ阻害剤RK-582は、APC 変異陽性大腸がん細胞のWnt/β-カテニンシグナルを遮断し、マウスゼノグラフトモデルにおけるin vivo 腫瘍増殖を抑制しました。これまでにラット、イヌ、およびサル等を用いた毒性試験、安全性薬理試験、ADME(注4) 等に関する検討を進め、治験開始に必要な非臨床データパッケージを構築しました。医薬品医療機器総合機構と非臨床試験の充足性および第Ⅰ相治験の治験デザインの適切性について合意に至り、がん研有明病院の治験倫理審査委員会の承認を得たのちに、治験を開始しました。
2.研究開発の概要
本治験は、切除不能進行・再発大腸がん患者を対象に、タンキラーゼ阻害剤RK-582の安全性および忍容性(主要評価項目)、ならびに有効性(副次的評価項目)を評価する第I相試験です(jRCT登録番号:jRCT2031240702、ClinicalTrials.gov:NCT06853496)。本治験では、組み入れ基準を満たし、同意が得られた患者を対象に治験薬の投与を実施し、経過観察を行います。がん抑制遺伝子 APC の機能喪失型変異により亢進した Wnt/β-カテニンシクナルを遮断するがん治療薬は、未だ世界で薬事承認されておらず、本治験がその道を切り拓くことを期待されています。
3.特記事項
本治験は、国立研究開発法人日本医療研究開発機構(AMED)革新的がん医療実用化研究事業「切除不能進行・再発大腸がんを対象としたタンキラーゼ阻害剤RK-582の医師主導第Ⅰ相治験」ならびに日本財団研究開発助成の支援によって行われています。また、本治験の基盤となる一連の基礎・探索的研究は、文部科学省・AMED次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)、AMED次世代がん医療創生研究事業(P-CREATE)・次世代がん医療加速化研究事業(P-PROMOTE)、AMED革新的がん医療実用化研究事業、文部科学省・日本学術振興会科学研究費、および日本財団の助成金によって実施されました。
【用語解説】
注1)タンキラーゼ
ポリADP-リボシル化酵素ファミリーの一員で、Wnt/β-カテニンシグナルの負の制御因子アキシンをポリADP-リボシル化し、その分解を促します。これにより、細胞内でβ-カテニンが増加します。
注2)Wnt/β-カテニンシグナル
細胞の増殖や分化を調節する生理的信号の一つです。大腸がんの多くではがん抑制遺伝子APCの機能が損なわれ、β-カテニンが細胞内に過剰に蓄積することでこの信号が増幅し、がんの発生や進展を招きます。
注3)ポリADP-リボシル化酵素
NAD+という分子を反応基質として、タンパク質に多数のADP-リボース分子を数珠つなぎに付加する酵素です。受け手となるタンパク質の種類に応じて、DNA修復やタンパク質分解など、様々な細胞応答が生じます。
注4)ADME
薬物を生体内に投与した際の一連の挙動をそれぞれの英語の頭文字で表しており、吸収(Absorption)、分布(Distribution)、代謝(Metabolism)、および排泄(Excretion)を指します。
■公益財団法人がん研究会について がん研究会は1908年に日本初のがん専門機関として発足して以来、100年以上にわたり日本のがん研究・がん医療において主導的な役割を果たしてきました。基礎的ながん研究を推進する「がん研究所」や、新薬開発やがんゲノム医療研究を推進する「がん化学療法センター」「がんプレシジョン医療研究センター」、さらに新しい医療の創造をする「がん研有明病院」を擁し、一体となってがんの克服を目指しています。
ウェブサイト: https://www.jfcr.or.jp/
本治験は、切除不能進行・再発大腸がん患者を対象に、RK-582の安全性および忍容性に加え、副次的に有効性を評価することを目的としております。本剤は、大腸がんの約 80%で見られるがん抑制遺伝子 APC の機能喪失型変異により亢進した Wnt/β-カテニンシグナル(注2)を遮断し(図1)、腫瘍組織の増殖を抑制することが非臨床のレベルで確認されています。今後は、投与症例の経過観察を通じて慎重に評価が進められます。
本治験は、上記研究機関がこれまでの非臨床の共同研究成果を、国立研究開発法人日本医療研究開発機構(AMED)の革新的がん医療実用化研究事業ならびに日本財団から研究開発費の支援を受け、基礎研究から臨床応用を実現したものです。RK-582の医師主導第Ⅰ相治験は、タンキラーゼ阻害剤として世界初の薬事承認取得を目指す試みであるとともに、新たな治療法を提供する重要な一歩と位置付けられます。

図1. タンキラーゼ阻害剤によるWnt/β-カテニンシグナルの遮断 大腸がんではがん抑制遺伝子APCが失活し、細胞増殖に寄与するβ-カテニンが蓄積しています。タンキラーゼはアキシンというタンパク質を分解に導くことでβ-カテニンを安定化します。培養細胞および実験動物を用いた検討により、RK-582はβ-カテニンの分解を誘導し、大腸がんの増殖を抑制することが実証されています。
1.研究開発の背景
我が国では年間15万人以上が大腸がんに罹患し、5万4千人が大腸がんで死亡しています。大腸がんは、早期であれば内視鏡治療や腹腔鏡下・開腹手術で対処可能であり、進行期においても、局所にとどまるがんや切除が可能な転移がんは治癒の可能性があります。しかし、切除不能進行・再発大腸がんは一般的に難治性であり、新薬の開発・提供が切望されています。
大腸がんの約80%は、がん抑制遺伝子APC の機能喪失型変異によりWnt/β-カテニンシグナルの亢進を示します。しかし、同経路には創薬展開が可能な標的分子が存在せず、このシグナルを遮断するがん治療薬の開発は困難とされてきました。ポリADP-リボシル化酵素(注3)ファミリーの一員であるタンキラーゼは、β-カテニンの抑制因子アキシンを分解に導くことでWnt/β-カテニンシグナルを増強します。このことから、タンキラーゼの阻害剤はアキシンの分解を阻害することでWnt/β-カテニンシグナルを抑制して、大腸がんの増殖などを抑える治療薬になる可能性があります。我々が創製したタンキラーゼ阻害剤RK-582は、APC 変異陽性大腸がん細胞のWnt/β-カテニンシグナルを遮断し、マウスゼノグラフトモデルにおけるin vivo 腫瘍増殖を抑制しました。これまでにラット、イヌ、およびサル等を用いた毒性試験、安全性薬理試験、ADME(注4) 等に関する検討を進め、治験開始に必要な非臨床データパッケージを構築しました。医薬品医療機器総合機構と非臨床試験の充足性および第Ⅰ相治験の治験デザインの適切性について合意に至り、がん研有明病院の治験倫理審査委員会の承認を得たのちに、治験を開始しました。
2.研究開発の概要
本治験は、切除不能進行・再発大腸がん患者を対象に、タンキラーゼ阻害剤RK-582の安全性および忍容性(主要評価項目)、ならびに有効性(副次的評価項目)を評価する第I相試験です(jRCT登録番号:jRCT2031240702、ClinicalTrials.gov:NCT06853496)。本治験では、組み入れ基準を満たし、同意が得られた患者を対象に治験薬の投与を実施し、経過観察を行います。がん抑制遺伝子 APC の機能喪失型変異により亢進した Wnt/β-カテニンシクナルを遮断するがん治療薬は、未だ世界で薬事承認されておらず、本治験がその道を切り拓くことを期待されています。
3.特記事項
本治験は、国立研究開発法人日本医療研究開発機構(AMED)革新的がん医療実用化研究事業「切除不能進行・再発大腸がんを対象としたタンキラーゼ阻害剤RK-582の医師主導第Ⅰ相治験」ならびに日本財団研究開発助成の支援によって行われています。また、本治験の基盤となる一連の基礎・探索的研究は、文部科学省・AMED次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)、AMED次世代がん医療創生研究事業(P-CREATE)・次世代がん医療加速化研究事業(P-PROMOTE)、AMED革新的がん医療実用化研究事業、文部科学省・日本学術振興会科学研究費、および日本財団の助成金によって実施されました。

4.本治験についてご理解いただきたいこと
本治験は、本邦初のタンキラーゼ阻害剤を投与する第I相試験で、今後、順調に開発が進んだ場合には、世界初のタンキラーゼ阻害作用を有するがん治療薬となる可能性があります。そのため、本治験では限られた患者を対象とすることと、医療チームによる管理を徹底することによって、患者の安全を最優先に製剤の安全性や忍容性を評価します。併せて製剤の有効性も探索的に評価します。本治験が計画通りに完了すれば、切除不能進行・再発大腸がん患者に対する新たな治療法を提供する重要な一歩となる可能性があります。
5.発表者・研究者等情報
・がん研究会
病院本部長・病院長 佐野武
消化器化学療法科 部長 山口研成
消化器化学療法科 副部長 篠崎英司
前研究本部長 野田哲生(現 名誉所長)
がん化学療法センター 分子生物治療研究部 部長 清宮啓之
・理化学研究所
環境資源科学研究センター
創薬化学基盤ユニット 上級研究員 白井文幸
【用語解説】
注1)タンキラーゼ
ポリADP-リボシル化酵素ファミリーの一員で、Wnt/β-カテニンシグナルの負の制御因子アキシンをポリADP-リボシル化し、その分解を促します。これにより、細胞内でβ-カテニンが増加します。
注2)Wnt/β-カテニンシグナル
細胞の増殖や分化を調節する生理的信号の一つです。大腸がんの多くではがん抑制遺伝子APCの機能が損なわれ、β-カテニンが細胞内に過剰に蓄積することでこの信号が増幅し、がんの発生や進展を招きます。
注3)ポリADP-リボシル化酵素
NAD+という分子を反応基質として、タンパク質に多数のADP-リボース分子を数珠つなぎに付加する酵素です。受け手となるタンパク質の種類に応じて、DNA修復やタンパク質分解など、様々な細胞応答が生じます。
注4)ADME
薬物を生体内に投与した際の一連の挙動をそれぞれの英語の頭文字で表しており、吸収(Absorption)、分布(Distribution)、代謝(Metabolism)、および排泄(Excretion)を指します。
■公益財団法人がん研究会について がん研究会は1908年に日本初のがん専門機関として発足して以来、100年以上にわたり日本のがん研究・がん医療において主導的な役割を果たしてきました。基礎的ながん研究を推進する「がん研究所」や、新薬開発やがんゲノム医療研究を推進する「がん化学療法センター」「がんプレシジョン医療研究センター」、さらに新しい医療の創造をする「がん研有明病院」を擁し、一体となってがんの克服を目指しています。
ウェブサイト: https://www.jfcr.or.jp/
関連PDF
- プレスリリース文書
 (573.3KB )
(573.3KB )