【プレスリリース】“天然物骨格リデザイン”が切り拓く中分子創薬―抗がん剤エクテナサイジンの再設計によるマクロ環状中分子群の創製―
2025年07月19日
発表のポイント
◆抗がん剤エクテナサイジン743(トラベクテジン)の骨格を戦略的に再設計し、14〜17員環の多様なマクロ環状中分子群を、従来法の約半分にあたる6〜10段階で合成する革新的な手法を確立しました。
◆得られた中分子群はDNA切断活性を保持しつつ、各種がん細胞株に対して極めて強力な増殖抑制効果を示し、マクロ環構造の差異に応じて活性プロファイルが変化することも明らかにしました。
◆構造・機能・合成容易性の最適化を実現する“天然物骨格リデザイン”の有効性を実証し、中分子創薬の新しいアプローチとして次世代抗がん剤開発への貢献が期待されます。
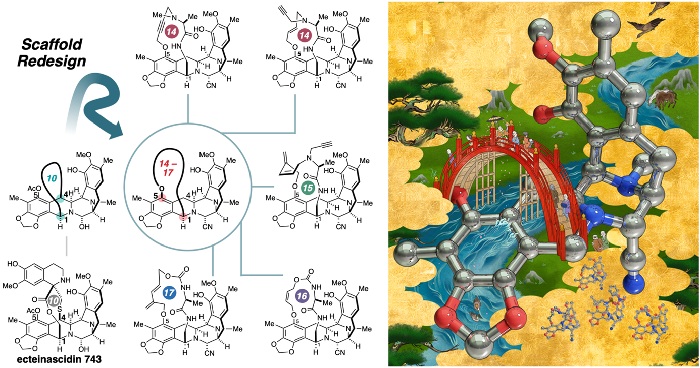
天然物骨格のリデザイン戦略による抗腫瘍性マクロ環状中分子群の創製
概要
東京大学大学院理学系研究科の谷藤涼助教、細野絵里奈氏(研究当時:修士課程)、鎌倉寿恵氏(研究当時:技術補佐員)、大栗博毅教授は、東京大学大学院工学系研究科の吉田知史大学院生、佐藤宗太特任教授、公益財団法人がん研究会がん化学療法センター分子生物治療研究部の村松由起子主任研究助手、清宮啓之部長、同センター分子薬理部の大橋愛美嘱託研究助手、旦慎吾部長らと共同で、海洋天然物(注1)由来のエクテナサイジン743(トラベクテジン、注2)の骨格構造を戦略的に再設計し、構造多様性と強力な抗腫瘍活性を両立する10種類以上のマクロ環状中分子(注3、4)を短工程で創製する合成プロセスを開発しました。得られた誘導体群はDNA二重鎖切断(注5)を誘導する活性を保持しながら、39種のヒトがん細胞株(JFCR39、注6)の増殖をサブナノモル濃度で強力に抑制しました。さらに、マクロ環構造の違いにより、各種がん細胞に対する活性プロファイルが大きく変化することも明らかとなり、入手困難な天然物を基盤とした抗がん剤開発における分子設計の新たな指針となることが期待されます。
※詳細はプレスリリースをご覧ください
◆抗がん剤エクテナサイジン743(トラベクテジン)の骨格を戦略的に再設計し、14〜17員環の多様なマクロ環状中分子群を、従来法の約半分にあたる6〜10段階で合成する革新的な手法を確立しました。
◆得られた中分子群はDNA切断活性を保持しつつ、各種がん細胞株に対して極めて強力な増殖抑制効果を示し、マクロ環構造の差異に応じて活性プロファイルが変化することも明らかにしました。
◆構造・機能・合成容易性の最適化を実現する“天然物骨格リデザイン”の有効性を実証し、中分子創薬の新しいアプローチとして次世代抗がん剤開発への貢献が期待されます。

天然物骨格のリデザイン戦略による抗腫瘍性マクロ環状中分子群の創製
概要
東京大学大学院理学系研究科の谷藤涼助教、細野絵里奈氏(研究当時:修士課程)、鎌倉寿恵氏(研究当時:技術補佐員)、大栗博毅教授は、東京大学大学院工学系研究科の吉田知史大学院生、佐藤宗太特任教授、公益財団法人がん研究会がん化学療法センター分子生物治療研究部の村松由起子主任研究助手、清宮啓之部長、同センター分子薬理部の大橋愛美嘱託研究助手、旦慎吾部長らと共同で、海洋天然物(注1)由来のエクテナサイジン743(トラベクテジン、注2)の骨格構造を戦略的に再設計し、構造多様性と強力な抗腫瘍活性を両立する10種類以上のマクロ環状中分子(注3、4)を短工程で創製する合成プロセスを開発しました。得られた誘導体群はDNA二重鎖切断(注5)を誘導する活性を保持しながら、39種のヒトがん細胞株(JFCR39、注6)の増殖をサブナノモル濃度で強力に抑制しました。さらに、マクロ環構造の違いにより、各種がん細胞に対する活性プロファイルが大きく変化することも明らかとなり、入手困難な天然物を基盤とした抗がん剤開発における分子設計の新たな指針となることが期待されます。
※詳細はプレスリリースをご覧ください
関連PDF
- プレスリリース文書
 (1,085.7KB )
(1,085.7KB )