�y�j���[�X�����[�X�z�|�h�v���j����W�I�Ƃ����V�������×p�q�g���R�̂̑n���`�����ÏW�@�\��W�I�Ƃ������×p���i�̊J���`
2022�N04��06��
�P�D�|�C���g
������ł��鍜������͂��߂Ƃ��鑽���̂���̍זE����ɂ́A�|�h�v���j���ƌĂ�镪�q�����p�x�ɔ������Ă���A���̃|�h�v���j���������ÏW�������N�����Ă���B
���|�h�v���j����̌����ÏW�U���Ɏ�v�Ȗ������ʂ����Ă���PLAG4�h���C���Ɍ������A���̌����ÏW�U��������j�Q����q�g�����a�R��AP201��n�����܂����B
���q�g�����a�R��AP201��ADCC������CDC�����������Ȃ��q�gIgG4�T�u�N���X�̍R�̂ł���A�{�R�̂𓊗^���邱�Ƃɂ��A�Տ����̂���������������Ȃǂ̑��B�Ɠ]�ڂ�}�����邱�Ƃɐ������܂����B
���q�g�����a�R��AP201���������镔�ʂ��}�E�X�|�h�v���j����ɓ��������m�b�N�C���}�E�X�ł��A�R�̓��^�ɔ����Ő�����͑S���F�߂�ꂸ�A���S���������Ǝ�������܂����B
�Q�D�����T�v
������w�Ö@�Z���^�[�̓��c���珊����̌����O���[�v�́A����זE�ɂ���ėU������錌���ÏW�U���@�\�̌�����i�߂Ă���A����܂łɁA����זE�ˑ��I�Ȍ����ÏW�Ɋւ�镪�q�Ƃ��Đ��E�ŏ��߂ă|�h�v���j�����q�i���蓖���ɂ�Aggrus�Ɩ����j�肵�Ă��܂����B���̏ڍׂȉ�͂��s�����ƂŁAPLAG4�h���C���ƐV�K�ɓ��肵�Ė����������ʂɋ��������ÏW�U�����������邱�ƁAPLAG4�h���C���Ɍ������|�h�v���j���ɂ�錌���ÏW��j�Q����}�E�X�R�q�g�|�h�v���j�����a�R��PG4D2���������邱�Ƃɐ������Ă��܂����B�|�h�v���j�����q�́A������ɔ������Ă���CLEC-2���q�ƌ������邱�ƂŌ����ÏW��U�����Ă��邽�߁A���������}�E�X���a�R��PG4D2�́A�|�h�v���j����CLEC-2���q�Ƃ̌����𗧑̓I�ɑj�Q���Ă��钆�a�R�̂ł��邱�Ƃ��킩���Ă��܂����i�}�P�j�B
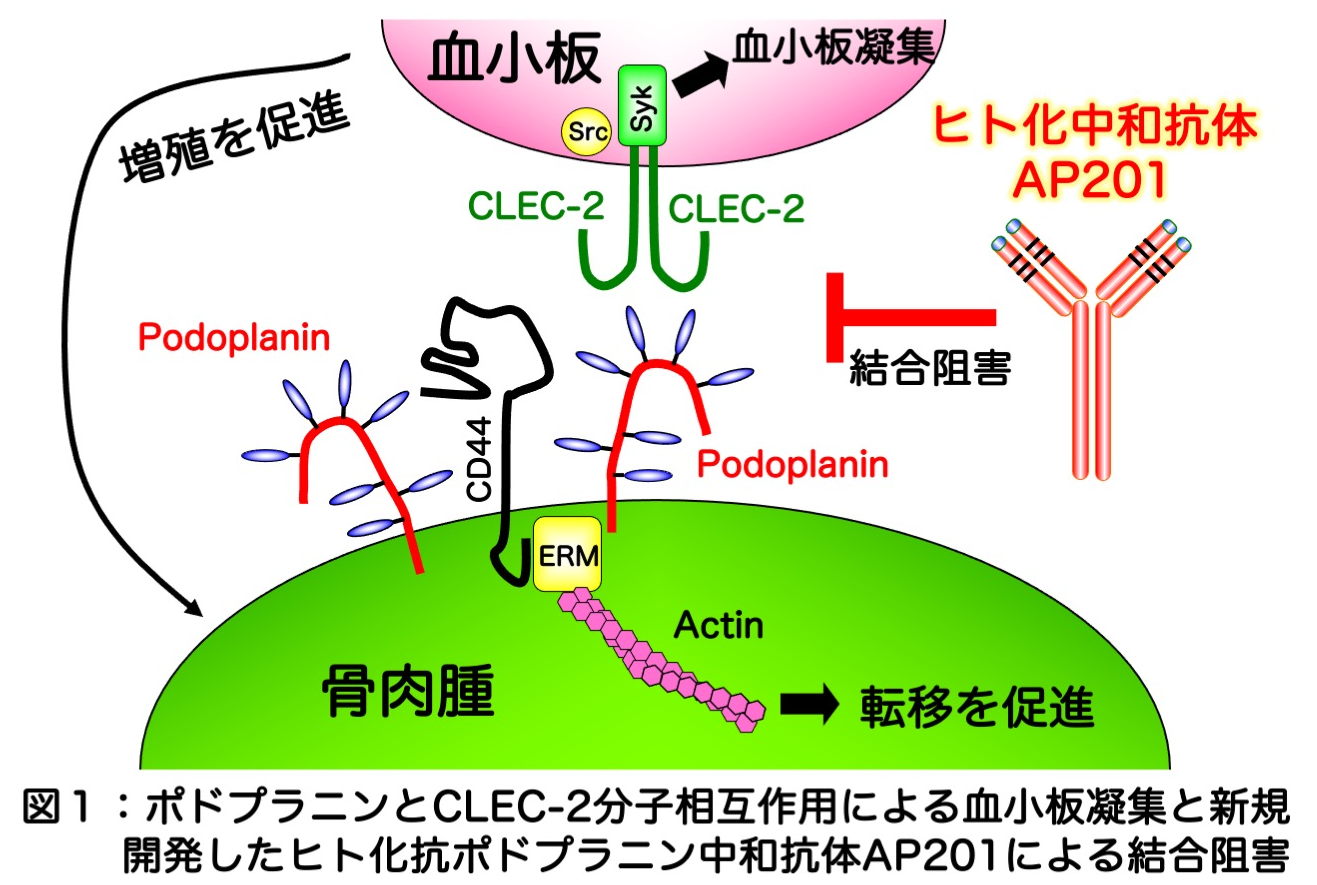
�|�h�v���j�����q�́AAYA����i15�`29�j���D���N��Ƃ��鍜����i��50�`100���l��1�l�Ƃ��������Ŕ����������j�ł��������������Ƃ����炩�ƂȂ��Ă��܂��B�����ŁA���c���珊���Ȃ�тɂ��w�Ö@�Z���^�[��b�������̒|�{����C��������A���ؑ��������A�F�����Y�������A�ЎR�ʕ�������̌����O���[�v�ƃA�s������Ј�Ɩ{���̌Y���L�F�W���A�`��q�W���A���R�a�]�ے��㗝�i�J�������j�A�s��������̌����O���[�v���������邱�ƂŁA�}�E�X���a�R��PG4D2�̃q�g���Ɏ��g�݁A�q�gIgG4�T�u�N���X�ł���q�g�����a�R��AP201��n�����邱�Ƃɐ������܂����i�}�P�j�B
���{�l�q�g������̂��������ꂽ�Տ����̗R���זE������I�זE�o���N�����肵���זE�������������ɈڐA���A�q�g�����a�R��AP201���^�ɂ�鎡�Î������s�����Ƃ���A�q�g�����a�R��AP201�̓��^�ɂ��A������̑��B�Ɠ]�ڂ��}�����邱�Ƃ��m�F����A�{�R�̂̍�����Âւ̉��p���\�ł��邱�Ƃ���������܂����B���M���ׂ��́A�q�g�����a�R��AP201�̔F�����ʂ��}�E�X�|�h�v���j���̑������ʂƒu�������m�b�N�C���}�E�X�iPDPN KI/KI�}�E�X�j�Ƀq�g�����a�R��AP201�𓊗^���Ă��A�Ɖu����������ƕς��Ȃ��}�E�X�ł���ɂ��ւ�炸�A�Ő��������悤�Ȓ���͔F�߂�ꂸ�A�q�g�����a�R��AP201�̈��S�����������Ƃ���������Ă��܂��B
�Ȃ��A�q�g�����a�R��AP201�������J�����Ă����A�s������Ђ́A����`����Ƃ̋������ƂƂ��Ă�COVID-19�ɑ��郏�N�`�������ɒ��͂��邱�ƂƂȂ�A�q�g�����a�R��AP201�̑S�Ă̌����i�m�����܂���̑O�Տ��J�����тɗՏ��J���ɂ����錠���j�͂�������p���Ă���܂��B
�{�����̐��ʂ́A�A�����J���w��iAACR�j�̋@�֎��̂P�ł���Clinical Cancer Research���ɁA2022�N4��5���Ɍ��J����܂����B
�R�D�_�����A���҂���т��̏���
���_����
Targeting podoplanin for the treatment of osteosarcoma
���W���[�i����
Clinical Cancer Research
�i���I�����C�����J�i doi: 10.1158/1078-0432.CCR-21-4509 �j����܂����j
������
�|�{��1, ���ؑ�1, �F�����Y1, �Y���L�F2, �`��q2, ��������1, ���і���1, Marie Lebel1, �͌�����3, ������3, ���R�a�]2, �s������2, �D���Y��4, ���]�[��4, ���{����5, ���Y�P��6, �|������6, ��c�N��7, �ЎR�ʕ�1, *���c����8�@(* �ӔC����)
�����҂̏����@��
1.������ ���w�Ö@�Z���^�[ ��b������
2.�A�s������Ё@��Ɩ{��
3.������ ����v���V�W������Ì����Z���^�[ ����Q�m����ÊJ���v���W�F�N�g
4.������ ���L���a�@ ���`�O��
5.������ ���L���a�@ �T���R�[�}�Z���^�[
6.������ ������ �a����
7.������ ������
8.������ ���w�Ö@�Z���^�[
�S�D�����̏ڍ�
�w�i�ƌo��
�ߔN�̂��Âł́A����ɓ����I�ȕ��q��W�I�Ƃ��邪�q�W�I���Ö��Ɖu�זE���Ċ���������Ɖu�`�F�b�N�|�C���g�j�Q��Ȃǂ̐V������܂ɂ�鎡�Â����S�I�Ȗ������ʂ����悤�ɂȂ��Ă��Ă��܂��B����ŁA�����������q�W�I���Ö��Ɖu�`�F�b�N�|�C���g�j�Q��Ȃǂ̐V������܂��K���ƂȂ邪���͌����Ă���A�����p�x���Ⴂ����i��`�Ƃ��ẮA�V�K�ɐf�f����邪��ł���N�Ԃ�10���l������6�ᖢ���ƂȂ锭�Ǘ��̂���ł��̂ŁA���{�̑��l�����P��2500���l�Ƃ���ƔN�Ԃł̐V�K���Ǘ��75��ȉ��ƂȂ�܂��j��W�I�Ƃ������i�̊J�����Ȃ��Ȃ��i�܂Ȃ��Ƃ���������܂��B���̗��R�Ƃ��ẮA����ł��邪�̂Ɏ��ÑΏۂƂȂ銳�҂̑��������Ȃ��ėՏ������̎��{���v���ɐi�߂��Ȃ����ƁA�܂��Ώۊ��Ґ������Ȃ��J������������ł��邱�ƂȂǂ��������܂��B
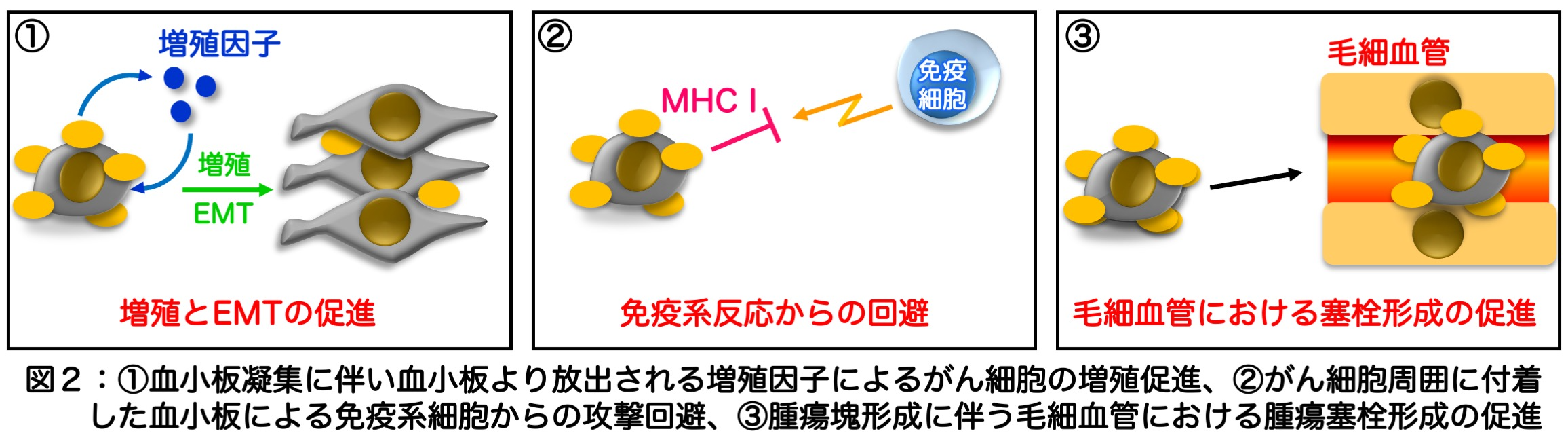
������̓��c����i���w�Ö@�Z���^�[ �����j��𒆐S�Ƃ��錤���O���[�v�́A����זE�ɂ���ėU������錌���ÏW�U���@�\�ɒ��ڂ��A���̊�b�����𑱂��Ă��܂����B���̗��R�́A�����ÏW�ɔ����Č��������o�����l�X�ȑ��B���q���A��ړI�ł���n�������ł͖����A����זE�̑��B�ɗ��p�����Ƃ������J�j�Y�������݂��邱�ƁA����ɁA�ÏW���������ɂ�肪��זE���͂��Z�̂悤�ɕ�����ƖƉu�זE�Ȃǂ���̍U��������ł���悤�ɂȂ邱�ƁA�����ɕ���ꂽ����זE�͌��Ǔ��ł̌����ɑς���ƂƂ��ɑ��̍זE�ƕt�����đ傫�Ȏ�ᇉ���`������悤�ɂȂ�A�ǐ��`������Ă���]�ڂ𑣐i���Ă��邱�ƂȂǂ��m���Ă���ׂł��i�}�Q�j�B
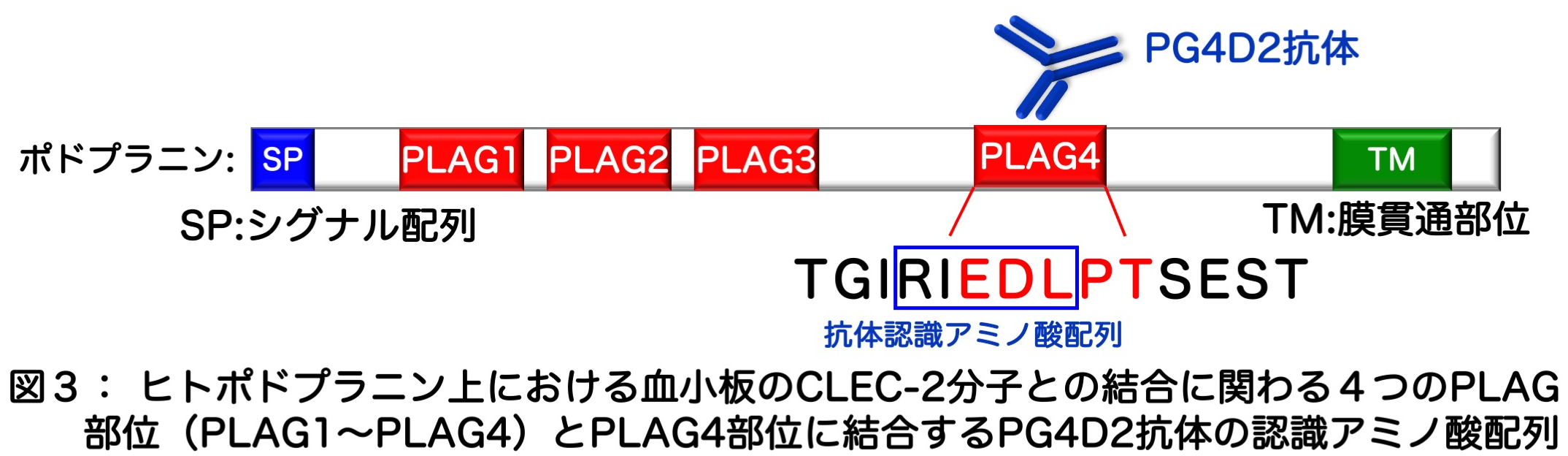
���c���珊����͂���܂łɁA���̂���זE�ˑ��I�Ȍ����ÏW�Ƀ|�h�v���j�����֗^���Ă��邱�Ƃ�2003�N�ɔ������Ă��܂����B�|�h�v���j���͌�����ɔ������Ă���CLEC-2�Ƃ������q�Ƒ��ݍ�p���邱�ƂŌ����ɋÏW��U������V�O�i����`�B���邱�Ƃ��������Ă��܂��B�����Ń|�h�v���j���̕��q�\�����ڂ������ׂ�CLEC-2�Ƃ̌����Ɋւ�镔�ʂ�T�����܂����B���̌��ʁA�|�h�v���j���ɂ͂S�̌����ÏW�Ɋւ�镔�ʁiPLAG�h���C���j�����݂��A���ɂ��̒���PLAG4�Ɩ����������ђʕ��ʂɋ߂����ʂ�CLEC-2�Ƃ̌����Ɏ�Ɋ֗^���Ă��邱�Ƃ����o���Ă��܂����B�����ł���PLAG4�h���C���Ɍ�������R�̂��}�E�X�ō쐻�����Ƃ���A�쐻���ꂽPG4D2�R�̂̓|�h�v���j����CLEC−�Q�Ƃ̌�����j�Q���A�|�h�v���j���ˑ��I�Ȍ����ÏW��j�Q�i���a�j�ł��邱�Ƃ�������܂����i�}�R�j�B
�����Ń|�h�v���j���̔��������i���Ă���q�g����������������ʁA����̈�ł��鍜����Ŕ������i���F�߂��邱�Ƃ�������܂����B������́AAYA����i15�`29�j���D���N��Ƃ��A��50�`100���l��1�l�Ƃ��������Ŕ���������ɋH�Ȃ���ł��B�]���^�̍R������ÂƎ�p�����Â̊�{�ƂȂ��Ă��܂����AAYA����ɂƂ������ƂŁA�]���^�̍R������ÂƎ�p�ł͔D�s���A�ӊ������ǁA����⋳�瓙�ւ̉e�������O����Ă���܂����A����ł��邪���߂ɐV�������q�W�I���Ö�̊J���͐i��ł��Ȃ��Ƃ������������A�V�������Ö@�̊J���������]�܂�Ă��邪��ł��B
��������
���{�l������ɂ�����|�h�v���j�������ƃ|�h�v���j���ˑ��I�Ȍ����ÏW��������̑��B�E�]�ڂɂǂ̂悤�ȉe�����y�ڂ��Ă��邩���������邽�߂ɁA��������̏����ϗ��R���ψ���ł̏��F�̌��A���L���a�@�Ŏ��Â������҂���̓��ӂ����������ŁA�o�C�I�v�V�[���̂��p���̂���Տ����̗R���זE���̎������s�Ȃ��܂����B���I�זE�o���N�R���̍�����ƍ��킹�č�����ɂ�����|�h�v���j��������͂����{���܂����B�܂��A�Տ����̗R���̑g�D�ؕЂł̃|�h�v���j�������ɂ��Ă��Ɖu�g�D���F�@�ɂČ������Ă݂܂����B���̌��ʁA�g�p����11�̍�����זE�����̖�6���ȏ�Ń|�h�v���j���̔��������i���Ă��邱�Ƃ��m�F�ł��܂����B�|�h�v���j������������������ł͌����ÏW�U�������������A���̌����ÏW�͇@�|�h�v���j����`�q���m�b�N�A�E�g�������ł͔F�߂��Ȃ����ƁA�APLAG4�h���C���Ɍ�������}�E�X���a�R��PG4D2��Y�����邱�Ƃŗ}������邱�ƂȂǂ���A������Ŕ������i���Ă���|�h�v���j���ɂ͌����ÏW�U�����������邱�Ƃ��m�F����܂����B����Ƀ}�E�X���a�R��PG4D2�𓊗^���邱�ƂŁA�}�E�X�ɈڐA����������̑��B�Ɠ]�ڂ��̃��x���ŗ}������邱�Ƃ��m�F����Ă��܂��B
�����ŁA�|�h�v���j����W�I�ɂ������a�R�̂����Ö�ւƓW�J���Ă������߂ɁA��`�q�g�݊����ɂ��}�E�X���a�R��PG4D2���q�g���R�̂ւƑg�݊����錟����i�߂܂����B�}�E�X�R�̂��q�g������ɂ������ẮA�|�h�v���j����CLEC-2�̌�����j�Q�ł���Ƃ����}�E�X���a�R��PG4D2�̗��_���ő剻����ƂƂ��ɗ\�����ʕ���p�����炵�Ĉ��S�������߂邽�߂ɁA�q�g�R�̂̒��ł�IgG4�T�u�N���X�Ƃ����A�y���u�����Y�}�u�Ȃǂ̖Ɖu�`�F�b�N�|�C���g�j�Q�܂Ȃǂɂ��̗p����Ă���T�u�N���X���̗p���č쐻��i�߂܂����B�ŏI�I�ɁAADCC�����i�R�̈ˑ����זE���Q��p�j��CDC�����i��̈ˑ����זE��Q��p�j���ጸ���ꂽ�q�g�����a�R��AP201���n���ł��܂����i�}�S�j�B���̃q�g�����a�R��AP201�́A�}�E�X���a�R��PG4D2�Ƒ��F�Ȃ��|�h�v���j���ւ̍��������\�������ƂƂ��ɁA�|�h�v���j����CLEC-2�̌�����j�Q���銈����ێ����Ă��܂����B
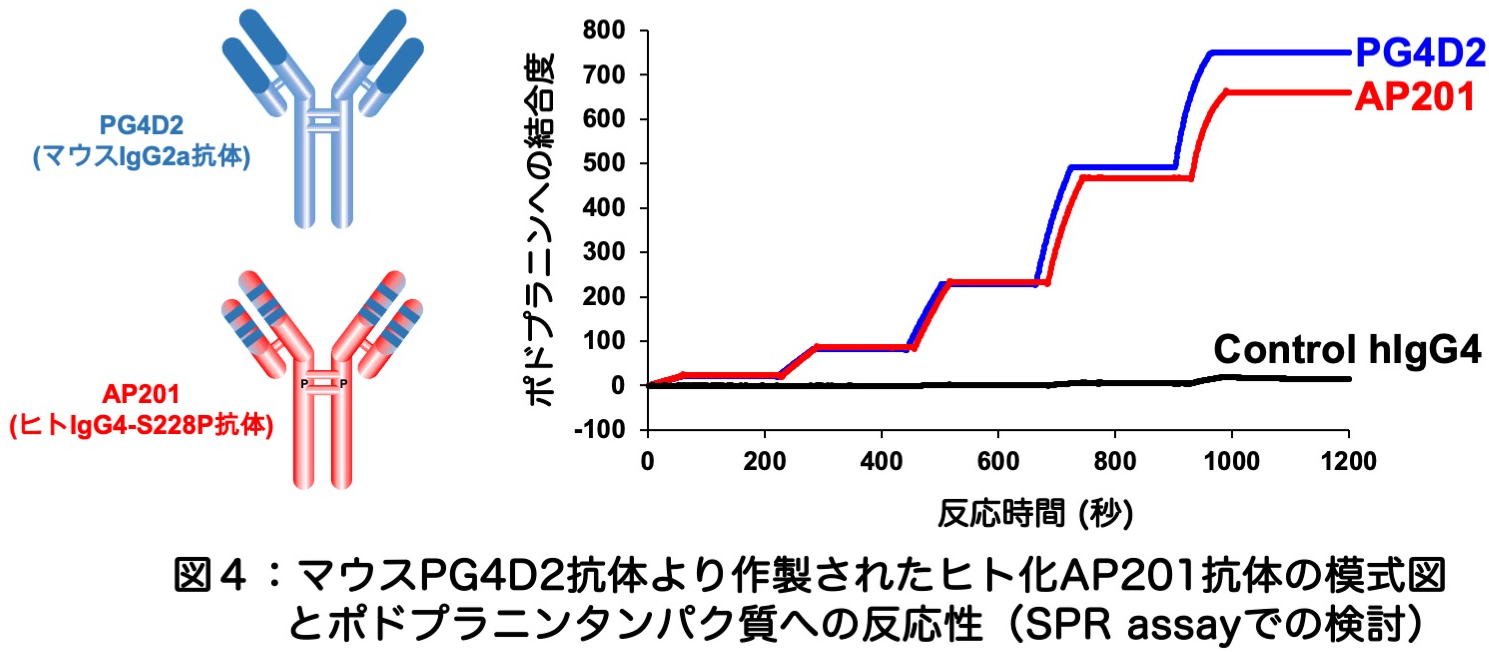
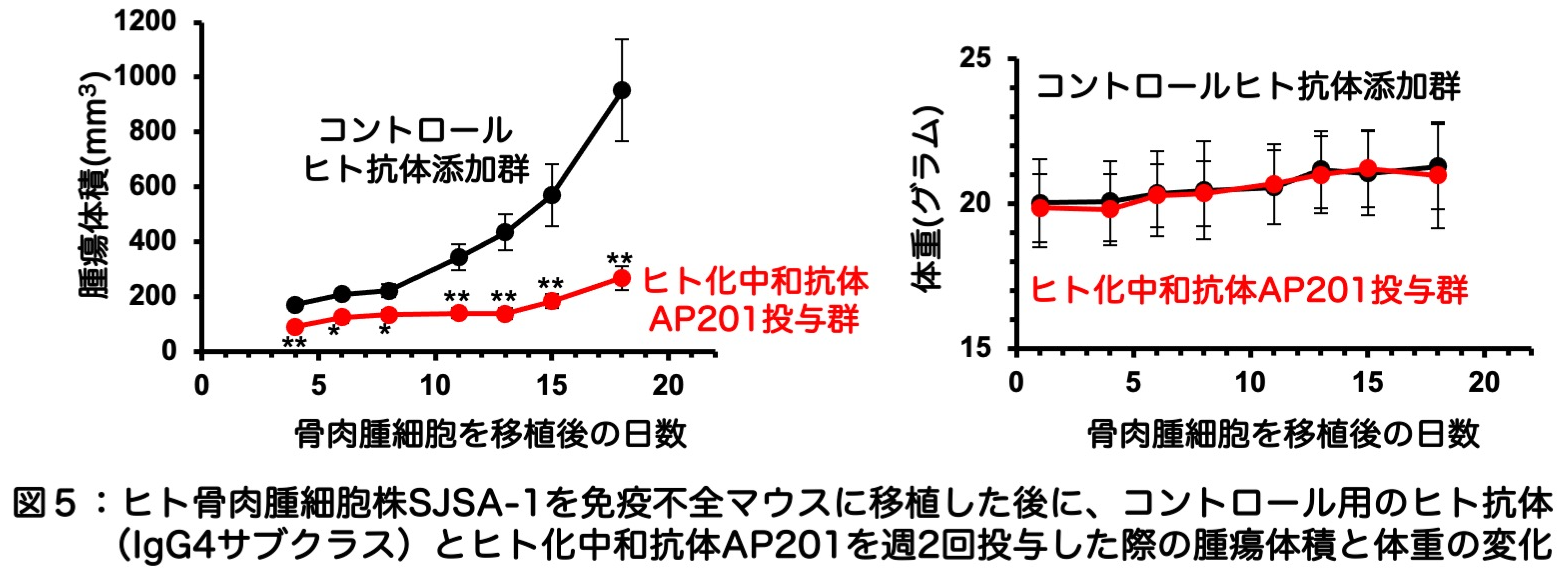
�쐻���ꂽ�q�g�����a�R��AP201�𓊗^���邱�ƂŁA�Ɖu�s�S�}�E�X�ɈڐA�����q�g������זE�̎�ᇑ��B���}������i�}�T�j�A�Ɖu�s�S�}�E�X�̔��Ö����q�g������זE���ڐA�����ۂɐ�����x�]�ڂ�}���ł��邱�Ƃ��m�F����Ă��܂��B�����̌������Ƀ}�E�X�̑̏d�������F�߂��邱�Ƃ͂Ȃ��A����ɁA�q�g�����a�R��AP201�̔F�����ʂ��}�E�X�|�h�v���j���̑������ʂƒu�������m�b�N�C���}�E�X�iPDPN KI/KI�}�E�X�j�Ƀq�g�����a�R��AP201��P�^�����ꍇ�ł��A���t�w�I�E���t�����w�I�ɂ��Ő��������悤�Ȓ���͑S���F�߂��܂���ł����B�m�b�N�C���}�E�X�̊e����ɂ�����a���w�I�Ȍ������ʂł��A�ُ�������悤�ȏ����͔F�߂��܂���ł����B��X�͈ȑO�ɁA�q�g�����a�R��AP201�̌��ł���}�E�X���a�R��PG4D2��p���ăm�b�N�C���}�E�X�iPDPN KI/KI�}�E�X�j�ɕ����^�����̂ł����A���̍ۂɂ����t�w�I�E���t�����w�I�Ȍ����A���邢�͕a���w�I�Ȍ����ł��ُ�������悤�ȏ����͑S���F�߂��Ă���܂���ł����B�����ŁA����̈��S�������̌��ʂ����킹�čl���܂��ƁA�쐻���ꂽ�q�g�����a�R��AP201�̈��S���͋ɂ߂č������Ƃ���������Ă��܂��B
����̓W�]
�|�h�v���j����W�I�Ƃ��邪�Ö�͂܂����p������Ă��܂���B�������A�{�������ʂȂǂɂ��A������זE��ɔ������Ă���|�h�v���j�����������ÏW�����邱�Ƃ��N�_�Ƃ��邱�ƂŁA������̑����]�ڂ����i����Ă��邱�Ƃ����炩�ƂȂ�܂����B�|�h�v���j���́A������ȊO�ɂ��]��ᇁE�H������E�x�G����炪��E���������E������ᇁE�N������ȂǗl�X�Ȃ���ł��������i���F�߂��Ă��܂��B����āA�{�������ʂŎ�����������ɑ��鎡�Ì��ʂ́A������ȊO�̂���ł��F�߂���\���������ƍl�����܂��B���ɁA�q�g�����a�R��AP201���邢�͍쐻���̃}�E�X���a�R��PG4D2��Ɖu�n������Ɠ����悤�Ɉێ�����Ă���m�b�N�C���}�E�X�iPDPN KI/KI�}�E�X�j�ɓ��^���Ă��Ő�����͑S���F�߂��Ȃ������Ƃ��������́A�q�g�ɑ��Ă����S�ɓ��^�ł���\���������Ă���A���̓_�ł����Ö�Ƃ��Ă̊J���\���͍����ƍl���Ă���܂��B����́A�Տ����������{���Ă��������鐻���Ƃ�T���ĘA�g���邱�ƂŁA�q�g�����a�R��AP201�������������҂���ɓ͂�����悤�ɁA�Տ��������܂ފJ�����p�����Ă����\��ł��B
�T�D�{�����ւ̎x��
�{�����́A���L�@�ւ�莑���I�x���Ȃǂ��邱�ƂŎ��{����܂����B
�����������J���@�l ���{��Ì����J���@�\�iAMED�j �����オ���Ñn���������ƁiP-CREATE�j
�����������J���@�l ���{��Ì����J���@�\�iAMED�j�Y�w�A�g��ÃC�m�x�[�V�����n�o�v���O�����E��{�X�L�[���iACT-M�j
�������Ȋw�� �Ȋw������⏕�� �V�w�p�̈挤���u�זE�Љ�_�C�o�[�V�e�B�[�̓����I�𖾂Ɛ���v
�����v���c�@�l ���{���c
�U�D�p����
�i���P�j �|�h�v���j��
�זE���\�ʏ�ɔ������Ă��铜�^���p�N���ł���A��������łȂ��A�]��ᇁE�H������E�x�G����炪��E���������E������ᇁE�N������Ȃǂɂ��������Ă��邱�Ƃ��m���Ă��܂��B���݂ł̓|�h�v���j���Ƃ������̂��L���p�����Ă��܂����A�e�X�̈�����ᇂ�זE�̃}�[�J�[���q�Ƃ��ĕ���Ă������Ƃ�����AAggrus��T1α�Agp36�AD2-40 antigen�AOTS-8�ȂǗl�X�ȕʖ��ŌĂ�ĕ���Ă��܂����B�������CLEC-2�Ƃ������q����������̕��q�ł���A����CLEC-2���q�Ƒ��ݍ�p���邱�ƂŌ����ɑ��Č����ÏW��U�����Ă��܂��B
�i���Q�j PLAG�h���C��
�|�h�v���j���̃A�~�m�_�z���ɂ́A�A�~�m�_�̈ꕶ���\�L��EDXXXT�iX�͗l�X�ȃA�~�m�_���\�Ǝv���Ă��܂��j�ƕ\�L�����z��ɗގ��������̂��A�זE�O�̕����Ɏ���ĂR�ӏ��^���f���ɑ��݂��邱�Ƃ����Ă���A������PLAG�h���C���iPLatelet AGgregation-stimulating domain�j�̂P�Ԗڂ���R�ԖڂƂ���PLAG1〜PLAG3�h���C���Ɩ������Ă��܂����B�ŋ߂ɂȂ�A����PLAG�h���C���ɗގ����Ă��Ď���ĕۑ�����Ă���EDXXT�Ƃ���ED��T�̊Ԃ̃A�~�m�_�����P���Ȃ����ʂ����o�����Ƃɐ������A���̕��ʂ�PLAG4�h���C���Ɩ������Ă��܂��B����PLAG�h���C����CLEC-2���q�Ƃ̌����ɓ��ɏd�v�ł���A�|�h�v���j���̌����ÏW�U�������Ɏ�v�Ȗ������ʂ����Ă��邱�Ƃ��킩���Ă��܂��B�{�������ʂőn�������q�g�����a�R��AP201���F�����Č�������̂�PLAG4�h���C���ł��B
�i��3�j �R��
�R�͖̂Ɖu�O���u�����Ƃ������̓��Ɍ����瑶�݂��A����ٕ̈���F�����Č������镪�q�ł���A�Ɖu�Ɋւ��d�v�ȕ��q�ł��B�O���琶�̓��ɐN�������ٕ��⌳���炠�鎩�����g�̍זE�Ƃ͈قȂ镪�q�����鈫����ᇍזE��E�C���X�Ɋ��������זE�ɍR�̂��������邱�ƂŁA���ٕ̈��Ɍ��������R�̂��ڈ�ƂȂ��ă}�N���t�@�[�W��D�������W�܂�A�ٕ������ÐH�iADCC�����ƌ����܂��j����ƂƂ��ɁA�ٕ��ƌ��������R�̂͐��̓��ɂ����̂Ƌ��͂��čזE�Ȃǂ�j��iCDC �����ƌ����܂��j���܂��B���̂悤�ȍR�̂͐��̓��ɂ���B�זE�ɂ����o����Ă��邽�߁A���̍R�̎Y��B�זE���ʂɔ|�{���邱�ƂŁA�ړI�Ƃ���ٕ��ɔ�������R�̂����i�Ƃ��ĉ��p���Ă���̂��A�R�̈��i�ƂȂ�܂��B
�i���S�j IgG4�T�u�N���X
�q�g�ł́AIgA�AIgD�AIgE�AIgG�AIgM�Ƃ����\����قȂ�T�̎�v�ȍR�̃A�C�\�^�C�v�����݂��Ă���A���ꂼ��̋@�\�Ȃǂ��قȂ��Ă��܂��B���̂���IgG�R�̂Ɋւ��ẮA�q�g�ł�IgG1�AIgG2�AIgG3�AIgG4�Ƃ���4�̃T�u�N���X�ɕ��ނ���Ă���AIgG1��IgG3�ɂ͍���ADCC�����ƍ���CDC����������AIgG2��ADCC������CDC�����ǂ�����Ⴂ���Ƃ��m���Ă��܂��BIgG4��ADCC�������ɂ߂ĒႭ�ACDC�����͖������Ƃ��m���Ă��܂��B���̂��߁AIgG4�T�u�N���X�̍R�͖̂Ɖu������U�������A�����Ƀ^���p�N���Ԃ̌�����j�Q����i����̏ꍇ�ł��ƃ|�h�v���j����CLEC-2�̌�����j�Q����j�Ƃ������_���ő剻�ł��܂��B�܂��AIgG4�T�u�N���X�̍R�͖̂Ɖu�����Ȃǂɂ��\�����ʕ���p��}���邱�Ƃ�ړI�Ƃ��Ă��p�����܂��B���ۂ�IgG4�T�u�N���X�̈��i�Ƃ��ẮA�Ɖu�`�F�b�N�|�C���g�j�Q�܂̃I�v�`�[�{�i���S�q�gIgG4�R�́j�A�L�[�g���_�[�i�q�g��IgG4�R�́j�Ȃǂ��������܂��B�}�E�XIgG�R�̂̃T�u�N���X�̖��͈̂قȂ��Ă���AIgG1�AIgG2a�AIgG2b�AIgG3�Ƃ���4�̃T�u�N���X�ɕ��ނ���Ă��܂��B�}�E�XIgG2a��IgG2b�ɂ͍���ADCC�����ƍ���CDC����������A�}�E�XIgG3�ɂ͍���ADCC�����ƒႢCDC����������A�}�E�XIgG1�́A�q�gIgG4�Ɠ�����ADCC������CDC�����͂Ƃ��ɒႢ�Ƃ���Ă��܂��B
�i��5�j �m�b�N�C���}�E�X
�O����`�q�����������̈�`�q����������悤�ɉ��ς�����`�q���σ}�E�X�́A������蕪�q�̐��̓��ł̋@�\��͂�i�߂��Ő����w�I�ɂ��傫�ȍv�����ʂ����Ă��Ă��܂��B���Ƀm�b�N�C���}�E�X�́A�W�I��`�q�̓���̈ʒu�ɓˑR�ψق��N�������Ƃ�O���̈�`�q��������`�q���σ}�E�X�̂��Ƃł���A����̕��q�̋@�\�⑼�̕��q�Ƃ̑��ݍ�p��͂Ȃǂɑ傫�ȍv�����ʂ����Ă��܂��B�{�������ʂŗp����PDPN KI/KI�m�b�N�C���}�E�X�ł́A�q�g�����a�R��AP201���F������q�g�|�h�v���j���̔z����}�E�X�|�h�v���j���̑����z��ƒu�������Ă���A���������m�b�N�C���}�E�X���쐻���邱�Ƃŏ��߂ăq�g�����a�R��AP201�̌̃��x���ł̈��S������@�\��͂��ł���悤�ɂȂ�܂����B
������ł��鍜������͂��߂Ƃ��鑽���̂���̍זE����ɂ́A�|�h�v���j���ƌĂ�镪�q�����p�x�ɔ������Ă���A���̃|�h�v���j���������ÏW�������N�����Ă���B
���|�h�v���j����̌����ÏW�U���Ɏ�v�Ȗ������ʂ����Ă���PLAG4�h���C���Ɍ������A���̌����ÏW�U��������j�Q����q�g�����a�R��AP201��n�����܂����B
���q�g�����a�R��AP201��ADCC������CDC�����������Ȃ��q�gIgG4�T�u�N���X�̍R�̂ł���A�{�R�̂𓊗^���邱�Ƃɂ��A�Տ����̂���������������Ȃǂ̑��B�Ɠ]�ڂ�}�����邱�Ƃɐ������܂����B
���q�g�����a�R��AP201���������镔�ʂ��}�E�X�|�h�v���j����ɓ��������m�b�N�C���}�E�X�ł��A�R�̓��^�ɔ����Ő�����͑S���F�߂�ꂸ�A���S���������Ǝ�������܂����B
�Q�D�����T�v
������w�Ö@�Z���^�[�̓��c���珊����̌����O���[�v�́A����זE�ɂ���ėU������錌���ÏW�U���@�\�̌�����i�߂Ă���A����܂łɁA����זE�ˑ��I�Ȍ����ÏW�Ɋւ�镪�q�Ƃ��Đ��E�ŏ��߂ă|�h�v���j�����q�i���蓖���ɂ�Aggrus�Ɩ����j�肵�Ă��܂����B���̏ڍׂȉ�͂��s�����ƂŁAPLAG4�h���C���ƐV�K�ɓ��肵�Ė����������ʂɋ��������ÏW�U�����������邱�ƁAPLAG4�h���C���Ɍ������|�h�v���j���ɂ�錌���ÏW��j�Q����}�E�X�R�q�g�|�h�v���j�����a�R��PG4D2���������邱�Ƃɐ������Ă��܂����B�|�h�v���j�����q�́A������ɔ������Ă���CLEC-2���q�ƌ������邱�ƂŌ����ÏW��U�����Ă��邽�߁A���������}�E�X���a�R��PG4D2�́A�|�h�v���j����CLEC-2���q�Ƃ̌����𗧑̓I�ɑj�Q���Ă��钆�a�R�̂ł��邱�Ƃ��킩���Ă��܂����i�}�P�j�B

�|�h�v���j�����q�́AAYA����i15�`29�j���D���N��Ƃ��鍜����i��50�`100���l��1�l�Ƃ��������Ŕ����������j�ł��������������Ƃ����炩�ƂȂ��Ă��܂��B�����ŁA���c���珊���Ȃ�тɂ��w�Ö@�Z���^�[��b�������̒|�{����C��������A���ؑ��������A�F�����Y�������A�ЎR�ʕ�������̌����O���[�v�ƃA�s������Ј�Ɩ{���̌Y���L�F�W���A�`��q�W���A���R�a�]�ے��㗝�i�J�������j�A�s��������̌����O���[�v���������邱�ƂŁA�}�E�X���a�R��PG4D2�̃q�g���Ɏ��g�݁A�q�gIgG4�T�u�N���X�ł���q�g�����a�R��AP201��n�����邱�Ƃɐ������܂����i�}�P�j�B
���{�l�q�g������̂��������ꂽ�Տ����̗R���זE������I�זE�o���N�����肵���זE�������������ɈڐA���A�q�g�����a�R��AP201���^�ɂ�鎡�Î������s�����Ƃ���A�q�g�����a�R��AP201�̓��^�ɂ��A������̑��B�Ɠ]�ڂ��}�����邱�Ƃ��m�F����A�{�R�̂̍�����Âւ̉��p���\�ł��邱�Ƃ���������܂����B���M���ׂ��́A�q�g�����a�R��AP201�̔F�����ʂ��}�E�X�|�h�v���j���̑������ʂƒu�������m�b�N�C���}�E�X�iPDPN KI/KI�}�E�X�j�Ƀq�g�����a�R��AP201�𓊗^���Ă��A�Ɖu����������ƕς��Ȃ��}�E�X�ł���ɂ��ւ�炸�A�Ő��������悤�Ȓ���͔F�߂�ꂸ�A�q�g�����a�R��AP201�̈��S�����������Ƃ���������Ă��܂��B
�Ȃ��A�q�g�����a�R��AP201�������J�����Ă����A�s������Ђ́A����`����Ƃ̋������ƂƂ��Ă�COVID-19�ɑ��郏�N�`�������ɒ��͂��邱�ƂƂȂ�A�q�g�����a�R��AP201�̑S�Ă̌����i�m�����܂���̑O�Տ��J�����тɗՏ��J���ɂ����錠���j�͂�������p���Ă���܂��B
�{�����̐��ʂ́A�A�����J���w��iAACR�j�̋@�֎��̂P�ł���Clinical Cancer Research���ɁA2022�N4��5���Ɍ��J����܂����B
�R�D�_�����A���҂���т��̏���
���_����
Targeting podoplanin for the treatment of osteosarcoma
���W���[�i����
Clinical Cancer Research
�i���I�����C�����J�i doi: 10.1158/1078-0432.CCR-21-4509 �j����܂����j
������
�|�{��1, ���ؑ�1, �F�����Y1, �Y���L�F2, �`��q2, ��������1, ���і���1, Marie Lebel1, �͌�����3, ������3, ���R�a�]2, �s������2, �D���Y��4, ���]�[��4, ���{����5, ���Y�P��6, �|������6, ��c�N��7, �ЎR�ʕ�1, *���c����8�@(* �ӔC����)
�����҂̏����@��
1.������ ���w�Ö@�Z���^�[ ��b������
2.�A�s������Ё@��Ɩ{��
3.������ ����v���V�W������Ì����Z���^�[ ����Q�m����ÊJ���v���W�F�N�g
4.������ ���L���a�@ ���`�O��
5.������ ���L���a�@ �T���R�[�}�Z���^�[
6.������ ������ �a����
7.������ ������
8.������ ���w�Ö@�Z���^�[
�S�D�����̏ڍ�
�w�i�ƌo��
�ߔN�̂��Âł́A����ɓ����I�ȕ��q��W�I�Ƃ��邪�q�W�I���Ö��Ɖu�זE���Ċ���������Ɖu�`�F�b�N�|�C���g�j�Q��Ȃǂ̐V������܂ɂ�鎡�Â����S�I�Ȗ������ʂ����悤�ɂȂ��Ă��Ă��܂��B����ŁA�����������q�W�I���Ö��Ɖu�`�F�b�N�|�C���g�j�Q��Ȃǂ̐V������܂��K���ƂȂ邪���͌����Ă���A�����p�x���Ⴂ����i��`�Ƃ��ẮA�V�K�ɐf�f����邪��ł���N�Ԃ�10���l������6�ᖢ���ƂȂ锭�Ǘ��̂���ł��̂ŁA���{�̑��l�����P��2500���l�Ƃ���ƔN�Ԃł̐V�K���Ǘ��75��ȉ��ƂȂ�܂��j��W�I�Ƃ������i�̊J�����Ȃ��Ȃ��i�܂Ȃ��Ƃ���������܂��B���̗��R�Ƃ��ẮA����ł��邪�̂Ɏ��ÑΏۂƂȂ銳�҂̑��������Ȃ��ėՏ������̎��{���v���ɐi�߂��Ȃ����ƁA�܂��Ώۊ��Ґ������Ȃ��J������������ł��邱�ƂȂǂ��������܂��B
������̓��c����i���w�Ö@�Z���^�[ �����j��𒆐S�Ƃ��錤���O���[�v�́A����זE�ɂ���ėU������錌���ÏW�U���@�\�ɒ��ڂ��A���̊�b�����𑱂��Ă��܂����B���̗��R�́A�����ÏW�ɔ����Č��������o�����l�X�ȑ��B���q���A��ړI�ł���n�������ł͖����A����זE�̑��B�ɗ��p�����Ƃ������J�j�Y�������݂��邱�ƁA����ɁA�ÏW���������ɂ�肪��זE���͂��Z�̂悤�ɕ�����ƖƉu�זE�Ȃǂ���̍U��������ł���悤�ɂȂ邱�ƁA�����ɕ���ꂽ����זE�͌��Ǔ��ł̌����ɑς���ƂƂ��ɑ��̍זE�ƕt�����đ傫�Ȏ�ᇉ���`������悤�ɂȂ�A�ǐ��`������Ă���]�ڂ𑣐i���Ă��邱�ƂȂǂ��m���Ă���ׂł��i�}�Q�j�B

���c���珊����͂���܂łɁA���̂���זE�ˑ��I�Ȍ����ÏW�Ƀ|�h�v���j�����֗^���Ă��邱�Ƃ�2003�N�ɔ������Ă��܂����B�|�h�v���j���͌�����ɔ������Ă���CLEC-2�Ƃ������q�Ƒ��ݍ�p���邱�ƂŌ����ɋÏW��U������V�O�i����`�B���邱�Ƃ��������Ă��܂��B�����Ń|�h�v���j���̕��q�\�����ڂ������ׂ�CLEC-2�Ƃ̌����Ɋւ�镔�ʂ�T�����܂����B���̌��ʁA�|�h�v���j���ɂ͂S�̌����ÏW�Ɋւ�镔�ʁiPLAG�h���C���j�����݂��A���ɂ��̒���PLAG4�Ɩ����������ђʕ��ʂɋ߂����ʂ�CLEC-2�Ƃ̌����Ɏ�Ɋ֗^���Ă��邱�Ƃ����o���Ă��܂����B�����ł���PLAG4�h���C���Ɍ�������R�̂��}�E�X�ō쐻�����Ƃ���A�쐻���ꂽPG4D2�R�̂̓|�h�v���j����CLEC−�Q�Ƃ̌�����j�Q���A�|�h�v���j���ˑ��I�Ȍ����ÏW��j�Q�i���a�j�ł��邱�Ƃ�������܂����i�}�R�j�B

�����Ń|�h�v���j���̔��������i���Ă���q�g����������������ʁA����̈�ł��鍜����Ŕ������i���F�߂��邱�Ƃ�������܂����B������́AAYA����i15�`29�j���D���N��Ƃ��A��50�`100���l��1�l�Ƃ��������Ŕ���������ɋH�Ȃ���ł��B�]���^�̍R������ÂƎ�p�����Â̊�{�ƂȂ��Ă��܂����AAYA����ɂƂ������ƂŁA�]���^�̍R������ÂƎ�p�ł͔D�s���A�ӊ������ǁA����⋳�瓙�ւ̉e�������O����Ă���܂����A����ł��邪���߂ɐV�������q�W�I���Ö�̊J���͐i��ł��Ȃ��Ƃ������������A�V�������Ö@�̊J���������]�܂�Ă��邪��ł��B
��������
���{�l������ɂ�����|�h�v���j�������ƃ|�h�v���j���ˑ��I�Ȍ����ÏW��������̑��B�E�]�ڂɂǂ̂悤�ȉe�����y�ڂ��Ă��邩���������邽�߂ɁA��������̏����ϗ��R���ψ���ł̏��F�̌��A���L���a�@�Ŏ��Â������҂���̓��ӂ����������ŁA�o�C�I�v�V�[���̂��p���̂���Տ����̗R���זE���̎������s�Ȃ��܂����B���I�זE�o���N�R���̍�����ƍ��킹�č�����ɂ�����|�h�v���j��������͂����{���܂����B�܂��A�Տ����̗R���̑g�D�ؕЂł̃|�h�v���j�������ɂ��Ă��Ɖu�g�D���F�@�ɂČ������Ă݂܂����B���̌��ʁA�g�p����11�̍�����זE�����̖�6���ȏ�Ń|�h�v���j���̔��������i���Ă��邱�Ƃ��m�F�ł��܂����B�|�h�v���j������������������ł͌����ÏW�U�������������A���̌����ÏW�͇@�|�h�v���j����`�q���m�b�N�A�E�g�������ł͔F�߂��Ȃ����ƁA�APLAG4�h���C���Ɍ�������}�E�X���a�R��PG4D2��Y�����邱�Ƃŗ}������邱�ƂȂǂ���A������Ŕ������i���Ă���|�h�v���j���ɂ͌����ÏW�U�����������邱�Ƃ��m�F����܂����B����Ƀ}�E�X���a�R��PG4D2�𓊗^���邱�ƂŁA�}�E�X�ɈڐA����������̑��B�Ɠ]�ڂ��̃��x���ŗ}������邱�Ƃ��m�F����Ă��܂��B
�����ŁA�|�h�v���j����W�I�ɂ������a�R�̂����Ö�ւƓW�J���Ă������߂ɁA��`�q�g�݊����ɂ��}�E�X���a�R��PG4D2���q�g���R�̂ւƑg�݊����錟����i�߂܂����B�}�E�X�R�̂��q�g������ɂ������ẮA�|�h�v���j����CLEC-2�̌�����j�Q�ł���Ƃ����}�E�X���a�R��PG4D2�̗��_���ő剻����ƂƂ��ɗ\�����ʕ���p�����炵�Ĉ��S�������߂邽�߂ɁA�q�g�R�̂̒��ł�IgG4�T�u�N���X�Ƃ����A�y���u�����Y�}�u�Ȃǂ̖Ɖu�`�F�b�N�|�C���g�j�Q�܂Ȃǂɂ��̗p����Ă���T�u�N���X���̗p���č쐻��i�߂܂����B�ŏI�I�ɁAADCC�����i�R�̈ˑ����זE���Q��p�j��CDC�����i��̈ˑ����זE��Q��p�j���ጸ���ꂽ�q�g�����a�R��AP201���n���ł��܂����i�}�S�j�B���̃q�g�����a�R��AP201�́A�}�E�X���a�R��PG4D2�Ƒ��F�Ȃ��|�h�v���j���ւ̍��������\�������ƂƂ��ɁA�|�h�v���j����CLEC-2�̌�����j�Q���銈����ێ����Ă��܂����B

�쐻���ꂽ�q�g�����a�R��AP201�𓊗^���邱�ƂŁA�Ɖu�s�S�}�E�X�ɈڐA�����q�g������זE�̎�ᇑ��B���}������i�}�T�j�A�Ɖu�s�S�}�E�X�̔��Ö����q�g������זE���ڐA�����ۂɐ�����x�]�ڂ�}���ł��邱�Ƃ��m�F����Ă��܂��B�����̌������Ƀ}�E�X�̑̏d�������F�߂��邱�Ƃ͂Ȃ��A����ɁA�q�g�����a�R��AP201�̔F�����ʂ��}�E�X�|�h�v���j���̑������ʂƒu�������m�b�N�C���}�E�X�iPDPN KI/KI�}�E�X�j�Ƀq�g�����a�R��AP201��P�^�����ꍇ�ł��A���t�w�I�E���t�����w�I�ɂ��Ő��������悤�Ȓ���͑S���F�߂��܂���ł����B�m�b�N�C���}�E�X�̊e����ɂ�����a���w�I�Ȍ������ʂł��A�ُ�������悤�ȏ����͔F�߂��܂���ł����B��X�͈ȑO�ɁA�q�g�����a�R��AP201�̌��ł���}�E�X���a�R��PG4D2��p���ăm�b�N�C���}�E�X�iPDPN KI/KI�}�E�X�j�ɕ����^�����̂ł����A���̍ۂɂ����t�w�I�E���t�����w�I�Ȍ����A���邢�͕a���w�I�Ȍ����ł��ُ�������悤�ȏ����͑S���F�߂��Ă���܂���ł����B�����ŁA����̈��S�������̌��ʂ����킹�čl���܂��ƁA�쐻���ꂽ�q�g�����a�R��AP201�̈��S���͋ɂ߂č������Ƃ���������Ă��܂��B

����̓W�]
�|�h�v���j����W�I�Ƃ��邪�Ö�͂܂����p������Ă��܂���B�������A�{�������ʂȂǂɂ��A������זE��ɔ������Ă���|�h�v���j�����������ÏW�����邱�Ƃ��N�_�Ƃ��邱�ƂŁA������̑����]�ڂ����i����Ă��邱�Ƃ����炩�ƂȂ�܂����B�|�h�v���j���́A������ȊO�ɂ��]��ᇁE�H������E�x�G����炪��E���������E������ᇁE�N������ȂǗl�X�Ȃ���ł��������i���F�߂��Ă��܂��B����āA�{�������ʂŎ�����������ɑ��鎡�Ì��ʂ́A������ȊO�̂���ł��F�߂���\���������ƍl�����܂��B���ɁA�q�g�����a�R��AP201���邢�͍쐻���̃}�E�X���a�R��PG4D2��Ɖu�n������Ɠ����悤�Ɉێ�����Ă���m�b�N�C���}�E�X�iPDPN KI/KI�}�E�X�j�ɓ��^���Ă��Ő�����͑S���F�߂��Ȃ������Ƃ��������́A�q�g�ɑ��Ă����S�ɓ��^�ł���\���������Ă���A���̓_�ł����Ö�Ƃ��Ă̊J���\���͍����ƍl���Ă���܂��B����́A�Տ����������{���Ă��������鐻���Ƃ�T���ĘA�g���邱�ƂŁA�q�g�����a�R��AP201�������������҂���ɓ͂�����悤�ɁA�Տ��������܂ފJ�����p�����Ă����\��ł��B
�T�D�{�����ւ̎x��
�{�����́A���L�@�ւ�莑���I�x���Ȃǂ��邱�ƂŎ��{����܂����B
�����������J���@�l ���{��Ì����J���@�\�iAMED�j �����オ���Ñn���������ƁiP-CREATE�j
�����������J���@�l ���{��Ì����J���@�\�iAMED�j�Y�w�A�g��ÃC�m�x�[�V�����n�o�v���O�����E��{�X�L�[���iACT-M�j
�������Ȋw�� �Ȋw������⏕�� �V�w�p�̈挤���u�זE�Љ�_�C�o�[�V�e�B�[�̓����I�𖾂Ɛ���v
�����v���c�@�l ���{���c
�U�D�p����
�i���P�j �|�h�v���j��
�זE���\�ʏ�ɔ������Ă��铜�^���p�N���ł���A��������łȂ��A�]��ᇁE�H������E�x�G����炪��E���������E������ᇁE�N������Ȃǂɂ��������Ă��邱�Ƃ��m���Ă��܂��B���݂ł̓|�h�v���j���Ƃ������̂��L���p�����Ă��܂����A�e�X�̈�����ᇂ�זE�̃}�[�J�[���q�Ƃ��ĕ���Ă������Ƃ�����AAggrus��T1α�Agp36�AD2-40 antigen�AOTS-8�ȂǗl�X�ȕʖ��ŌĂ�ĕ���Ă��܂����B�������CLEC-2�Ƃ������q����������̕��q�ł���A����CLEC-2���q�Ƒ��ݍ�p���邱�ƂŌ����ɑ��Č����ÏW��U�����Ă��܂��B
�i���Q�j PLAG�h���C��
�|�h�v���j���̃A�~�m�_�z���ɂ́A�A�~�m�_�̈ꕶ���\�L��EDXXXT�iX�͗l�X�ȃA�~�m�_���\�Ǝv���Ă��܂��j�ƕ\�L�����z��ɗގ��������̂��A�זE�O�̕����Ɏ���ĂR�ӏ��^���f���ɑ��݂��邱�Ƃ����Ă���A������PLAG�h���C���iPLatelet AGgregation-stimulating domain�j�̂P�Ԗڂ���R�ԖڂƂ���PLAG1〜PLAG3�h���C���Ɩ������Ă��܂����B�ŋ߂ɂȂ�A����PLAG�h���C���ɗގ����Ă��Ď���ĕۑ�����Ă���EDXXT�Ƃ���ED��T�̊Ԃ̃A�~�m�_�����P���Ȃ����ʂ����o�����Ƃɐ������A���̕��ʂ�PLAG4�h���C���Ɩ������Ă��܂��B����PLAG�h���C����CLEC-2���q�Ƃ̌����ɓ��ɏd�v�ł���A�|�h�v���j���̌����ÏW�U�������Ɏ�v�Ȗ������ʂ����Ă��邱�Ƃ��킩���Ă��܂��B�{�������ʂőn�������q�g�����a�R��AP201���F�����Č�������̂�PLAG4�h���C���ł��B
�i��3�j �R��
�R�͖̂Ɖu�O���u�����Ƃ������̓��Ɍ����瑶�݂��A����ٕ̈���F�����Č������镪�q�ł���A�Ɖu�Ɋւ��d�v�ȕ��q�ł��B�O���琶�̓��ɐN�������ٕ��⌳���炠�鎩�����g�̍זE�Ƃ͈قȂ镪�q�����鈫����ᇍזE��E�C���X�Ɋ��������זE�ɍR�̂��������邱�ƂŁA���ٕ̈��Ɍ��������R�̂��ڈ�ƂȂ��ă}�N���t�@�[�W��D�������W�܂�A�ٕ������ÐH�iADCC�����ƌ����܂��j����ƂƂ��ɁA�ٕ��ƌ��������R�̂͐��̓��ɂ����̂Ƌ��͂��čזE�Ȃǂ�j��iCDC �����ƌ����܂��j���܂��B���̂悤�ȍR�̂͐��̓��ɂ���B�זE�ɂ����o����Ă��邽�߁A���̍R�̎Y��B�זE���ʂɔ|�{���邱�ƂŁA�ړI�Ƃ���ٕ��ɔ�������R�̂����i�Ƃ��ĉ��p���Ă���̂��A�R�̈��i�ƂȂ�܂��B
�i���S�j IgG4�T�u�N���X
�q�g�ł́AIgA�AIgD�AIgE�AIgG�AIgM�Ƃ����\����قȂ�T�̎�v�ȍR�̃A�C�\�^�C�v�����݂��Ă���A���ꂼ��̋@�\�Ȃǂ��قȂ��Ă��܂��B���̂���IgG�R�̂Ɋւ��ẮA�q�g�ł�IgG1�AIgG2�AIgG3�AIgG4�Ƃ���4�̃T�u�N���X�ɕ��ނ���Ă���AIgG1��IgG3�ɂ͍���ADCC�����ƍ���CDC����������AIgG2��ADCC������CDC�����ǂ�����Ⴂ���Ƃ��m���Ă��܂��BIgG4��ADCC�������ɂ߂ĒႭ�ACDC�����͖������Ƃ��m���Ă��܂��B���̂��߁AIgG4�T�u�N���X�̍R�͖̂Ɖu������U�������A�����Ƀ^���p�N���Ԃ̌�����j�Q����i����̏ꍇ�ł��ƃ|�h�v���j����CLEC-2�̌�����j�Q����j�Ƃ������_���ő剻�ł��܂��B�܂��AIgG4�T�u�N���X�̍R�͖̂Ɖu�����Ȃǂɂ��\�����ʕ���p��}���邱�Ƃ�ړI�Ƃ��Ă��p�����܂��B���ۂ�IgG4�T�u�N���X�̈��i�Ƃ��ẮA�Ɖu�`�F�b�N�|�C���g�j�Q�܂̃I�v�`�[�{�i���S�q�gIgG4�R�́j�A�L�[�g���_�[�i�q�g��IgG4�R�́j�Ȃǂ��������܂��B�}�E�XIgG�R�̂̃T�u�N���X�̖��͈̂قȂ��Ă���AIgG1�AIgG2a�AIgG2b�AIgG3�Ƃ���4�̃T�u�N���X�ɕ��ނ���Ă��܂��B�}�E�XIgG2a��IgG2b�ɂ͍���ADCC�����ƍ���CDC����������A�}�E�XIgG3�ɂ͍���ADCC�����ƒႢCDC����������A�}�E�XIgG1�́A�q�gIgG4�Ɠ�����ADCC������CDC�����͂Ƃ��ɒႢ�Ƃ���Ă��܂��B
�i��5�j �m�b�N�C���}�E�X
�O����`�q�����������̈�`�q����������悤�ɉ��ς�����`�q���σ}�E�X�́A������蕪�q�̐��̓��ł̋@�\��͂�i�߂��Ő����w�I�ɂ��傫�ȍv�����ʂ����Ă��Ă��܂��B���Ƀm�b�N�C���}�E�X�́A�W�I��`�q�̓���̈ʒu�ɓˑR�ψق��N�������Ƃ�O���̈�`�q��������`�q���σ}�E�X�̂��Ƃł���A����̕��q�̋@�\�⑼�̕��q�Ƃ̑��ݍ�p��͂Ȃǂɑ傫�ȍv�����ʂ����Ă��܂��B�{�������ʂŗp����PDPN KI/KI�m�b�N�C���}�E�X�ł́A�q�g�����a�R��AP201���F������q�g�|�h�v���j���̔z����}�E�X�|�h�v���j���̑����z��ƒu�������Ă���A���������m�b�N�C���}�E�X���쐻���邱�Ƃŏ��߂ăq�g�����a�R��AP201�̌̃��x���ł̈��S������@�\��͂��ł���悤�ɂȂ�܂����B
�֘APDF
- �j���[�X�����[�X����
 (808.6KB )
(808.6KB )