【ニュースリリース】染色体分離を制御するセパレース活性制御機構の解明 −がんの染色体分離異常に着目した、新たな治療法につながる成果−
2022年12月06日
1.ポイント
●セパレース活性化動態の異常を防ぐための分子メカニズムを解明しました。
●セパレースの自己切断によって、染色体分離直前のサイクリンB1によるセパレース活性制御が増強されました。
●サイクリンB1によるセパレース活性制御が弱くなると、染色体分離異常が頻発しました。
●セパレース活性動態の異常を防ぐための機構は、がんの染色体分離異常に着目した新たな治療法の標的となることが期待されます。
2.概要
がん細胞は盛んに分裂を繰り返して増殖します。その過程で、染色体分離※1の異常を頻繁に引き起こしてしまうため、染色体数が多様な細胞(異数体細胞※2といいます)が多く作り出されています。このような染色体分離の異常ががん細胞で頻発する原因については、これまでの研究で、がん細胞では染色体分離のトリガーとなるセパレース※3という酵素の活性が早期に漏洩してしまう、ということまではつきとめられていました。セパレースの活性制御機構として、セキュリンとサイクリンB1の結合による活性抑制機構があることはわかっていましたが、活性化動態の異常が生じるメカニズムを十分には説明できていませんでした。
がん研究会がん研究所・実験病理部の広田亨(ひろたとおる)部長の研究チームは、セパレースの活性化動態の異常を防ぐための機構として、サイクリンB1によるセパレース活性制御を促進する機構が存在することを発見しました。この機構によりセパレース活性の早期漏洩が防止され、染色体分離の異常が防止されていました。
本研究は、元実験病理部研究員・現宮城県立がんセンター(安田純研究所長)の進藤軌久研究員と東北大学加齢医学研究所(川島隆太研究所長)の田中耕三教授との共同研究で行われました。
本研究成果は、2022年11月29日(日本時間11月30日、午前1時)に米国科学雑誌「Cell Reports」オンライン版に掲載されました。
3.論文名、著者およびその所属
○論文名
Autocleavage of separase suppresses its premature activation by promoting binding to cyclin B1
○掲載誌名
Cell Reports
(※日本時間2022年11月30日、午前1時にオンラインに掲載されました。)
○著者
Norihisa Shindo1*, Kazuki Kumada2, Kenji Iemura3, Jun Yasuda1, Haruna Fujimori4, Mai Mochizuki4, Keiichi Tamai4, Kozo Tanaka3 and Toru Hirota5
(*責任著者)
○著者の所属機関
1.宮城県立がんセンター 研究所 発がん制御研究部
2.東北大学 東北メディカル・メガバンク機構
3.東北大学 加齢医学研究所 分子腫瘍学研究分野
4.宮城県立がんセンター 研究所 がん幹細胞研究部
5.(公財)がん研究会 がん研究所 実験病理部
○DOI
https://doi.org/10.1016/j.celrep.2022.111723
4.研究の詳細
背景と経緯
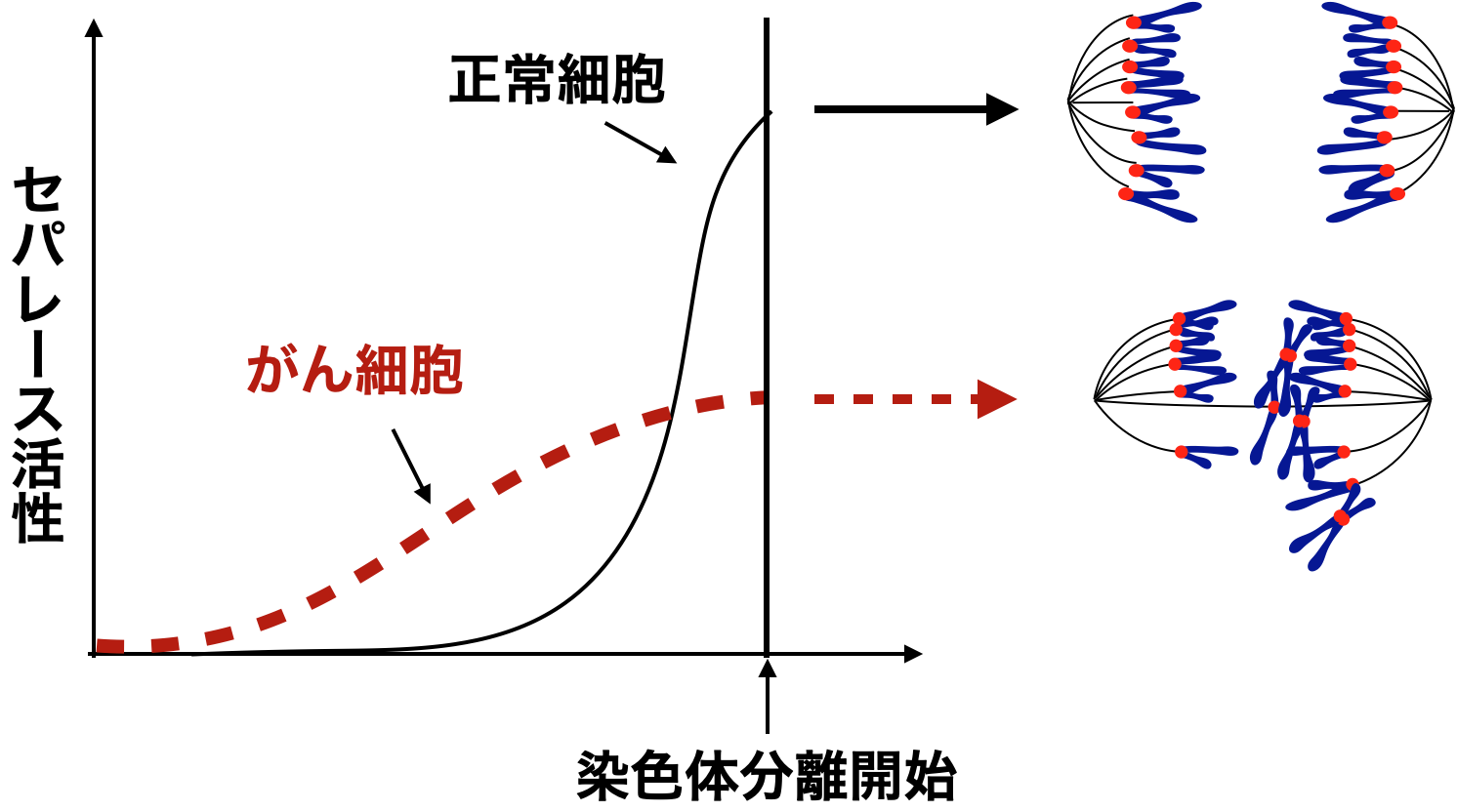
がんの治療を困難にする理由のひとつに、がん細胞の多様性が高いという問題があります。がん細胞は盛んに細胞分裂を行いますが、その分裂の過程で染色体分離の異常が頻発しています。そのため、多くのがん細胞は染色体数が通常の46本から大きく逸脱した異数体と呼ばれる状態になっています。そして、分裂するたびに新たな異数体細胞が作り出され、それによってさらにがん細胞の多様性は増大してしまいます。研究グループはこれまでに、染色体分離のトリガーとなるセパレースというタンパク質分解酵素の活性化動態の異常が、がん細胞の異数体化を促進する機構に関与していることをつきとめていました(図1)。すなわち、がん細胞では染色体分離開始のはるか前からセパレース活性の漏洩が見られ、その後、急峻な活性化が起きずに低活性化状態のまま染色体分離を開始していました。
セパレースの活性を制御する因子としてセキュリンとサイクリンB1が存在することが知られています。これらの因子がセパレースに結合すると活性が抑制され、セパレースからはずれることで活性化します。セキュリンとサイクリンB1は同時にセパレースに結合することはなく、セキュリンが結合している状態のセパレースとサイクリンB1と結合している状態のセパレースでは構造に違いがあることがわかっていました(図2)。しかし、これらがどのようにして厳重なセパレース活性制御を行い、急峻な活性化を可能にしているかについては不明なままでした。

研究内容
分裂期の染色体分離は、セパレースが姉妹染色分体をつなぎとめているコヒーシンを切断することで引き起こされます。セパレースはこのとき、コヒーシン以外にもセパレース自身を切断する「自己切断」を行うことは知られていましたが、その意義はよくわかっていませんでした。研究グループは、このセパレースの自己切断に着目し、その阻害によってどのような影響がでるかを検討しました。
今回の研究で、セパレースの自己切断を阻害した細胞では非常に重篤な染色体分離エラーが生じることがわかりました。そして、セパレース活性プローブを用いてセパレース活性化プロファイルの解析を行ったところ、がん細胞でみられたようなセパレース活性化動態の異常、すなわち、染色体分離開始のはるか前からセパレース活性の漏洩が見られ、低活性化状態のまま異常な染色体分離を開始していました。
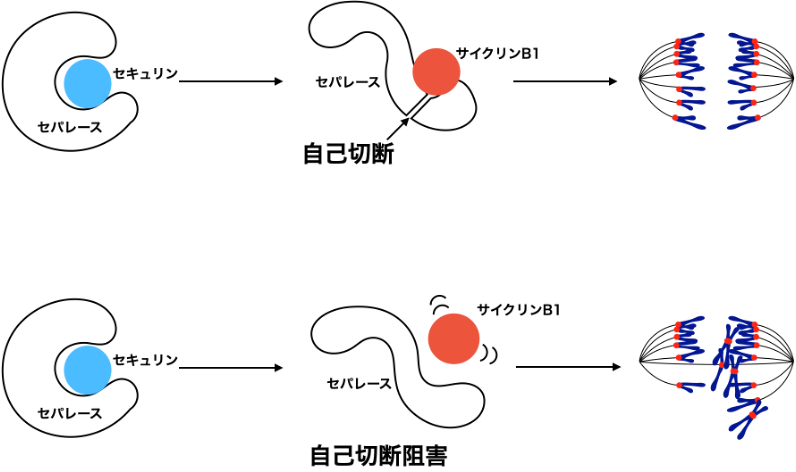
このような活性化動態の異常がなぜ起こるのかについて、さらに検討を進めたところ、以下のことがあきらかになりました。1)セパレースは分裂期の前半はセキュリンによって活性制御を受け、2)その後、染色体分離直前にサイクリンB1が置き換わる形でセパレース活性の早期漏洩を抑制していますが、3)そのときにセパレースの自己切断がサイクリンB1との結合を安定化することでより強固な活性抑制をしていました(図3)。
これらの研究により、セパレースの活性動態の異常を防ぐメカニズムがみいだされ、正確な染色体分離を保証するための機構の理解が深まりました。
今後の展開
がん細胞の多様性が治療を困難にしていますが、その多様性を生み出す原因である染色体分離異常が生じるしくみは多くのがんで共通しています。この共通の性質を治療の標的とすることができれば、多くの進行癌を制御できるようになることが期待され、世界中で盛んに研究され始めています。今回の研究で解明したセパレース活性動態の異常を防ぐための機構は、がん細胞共通の弱点である可能性があり、がんの染色体分離異常に着目した新たな治療法の標的となると考えられます。
5.本研究への支援
本研究は、以下の支援を受けて実施されました。
・文部科学省科学研究費補助金 基盤研究(A)22H00458、基盤研究(C)19K07677ならびに21K07111、若手研究(A)25711003
6.用語解説
(※1)染色体分離
細胞の遺伝情報は染色体という構造体に含まれており、ヒトの細胞には46本の染色体があります。細胞が分裂する前にゲノム情報が複製され、92本の姉妹染色分体と呼ばれる構造体ができますが、お互いのコピーである姉妹の染色分体はすぐには分離せず、コヒーシンと呼ばれる接着因子によって繋ぎとめられています。細胞が分裂して2つの娘細胞ができるときに、このコヒーシンがセパレースと呼ばれるタンパク質分解酵素によって切断され、それぞれの染色体は均等に娘細胞に分配されます。がん細胞ではこの染色体分離過程にエラーが生じて、異数体細胞※2が作りだされています。
(※2)異数体細胞
上述のようにヒトの細胞の染色体数は46本ですが、多くのがん細胞はそこから大きく逸脱した染色体数になっています。このように染色体数が46本以外の多様な本数になっている細胞を異数体細胞と呼びます。染色体は遺伝情報を含んでいますので、その本数がバラバラということは異なる性質を持った細胞、すなわち多様性の高い細胞、が多く存在しているということになります。このようながん細胞の多様性は、がんの治療を難しくする一因となっています。
(※3)セパレース
染色体分離時、姉妹染色分体間のコヒーシンを切断するタンパク質分解酵素です。染色体分離以前には、セキュリンとサイクリンB1が結合することによってセパレース活性は抑制されています。セパレースはコヒーシン以外にもセパレース自身も切断する「自己切断」と呼ばれる活性を持っています。本研究はこの自己切断の意義の解明から発展しました。
●セパレース活性化動態の異常を防ぐための分子メカニズムを解明しました。
●セパレースの自己切断によって、染色体分離直前のサイクリンB1によるセパレース活性制御が増強されました。
●サイクリンB1によるセパレース活性制御が弱くなると、染色体分離異常が頻発しました。
●セパレース活性動態の異常を防ぐための機構は、がんの染色体分離異常に着目した新たな治療法の標的となることが期待されます。
2.概要
がん細胞は盛んに分裂を繰り返して増殖します。その過程で、染色体分離※1の異常を頻繁に引き起こしてしまうため、染色体数が多様な細胞(異数体細胞※2といいます)が多く作り出されています。このような染色体分離の異常ががん細胞で頻発する原因については、これまでの研究で、がん細胞では染色体分離のトリガーとなるセパレース※3という酵素の活性が早期に漏洩してしまう、ということまではつきとめられていました。セパレースの活性制御機構として、セキュリンとサイクリンB1の結合による活性抑制機構があることはわかっていましたが、活性化動態の異常が生じるメカニズムを十分には説明できていませんでした。
がん研究会がん研究所・実験病理部の広田亨(ひろたとおる)部長の研究チームは、セパレースの活性化動態の異常を防ぐための機構として、サイクリンB1によるセパレース活性制御を促進する機構が存在することを発見しました。この機構によりセパレース活性の早期漏洩が防止され、染色体分離の異常が防止されていました。
本研究は、元実験病理部研究員・現宮城県立がんセンター(安田純研究所長)の進藤軌久研究員と東北大学加齢医学研究所(川島隆太研究所長)の田中耕三教授との共同研究で行われました。
本研究成果は、2022年11月29日(日本時間11月30日、午前1時)に米国科学雑誌「Cell Reports」オンライン版に掲載されました。
3.論文名、著者およびその所属
○論文名
Autocleavage of separase suppresses its premature activation by promoting binding to cyclin B1
○掲載誌名
Cell Reports
(※日本時間2022年11月30日、午前1時にオンラインに掲載されました。)
○著者
Norihisa Shindo1*, Kazuki Kumada2, Kenji Iemura3, Jun Yasuda1, Haruna Fujimori4, Mai Mochizuki4, Keiichi Tamai4, Kozo Tanaka3 and Toru Hirota5
(*責任著者)
○著者の所属機関
1.宮城県立がんセンター 研究所 発がん制御研究部
2.東北大学 東北メディカル・メガバンク機構
3.東北大学 加齢医学研究所 分子腫瘍学研究分野
4.宮城県立がんセンター 研究所 がん幹細胞研究部
5.(公財)がん研究会 がん研究所 実験病理部
○DOI
https://doi.org/10.1016/j.celrep.2022.111723
4.研究の詳細
背景と経緯
がんの治療を困難にする理由のひとつに、がん細胞の多様性が高いという問題があります。がん細胞は盛んに細胞分裂を行いますが、その分裂の過程で染色体分離の異常が頻発しています。そのため、多くのがん細胞は染色体数が通常の46本から大きく逸脱した異数体と呼ばれる状態になっています。そして、分裂するたびに新たな異数体細胞が作り出され、それによってさらにがん細胞の多様性は増大してしまいます。研究グループはこれまでに、染色体分離のトリガーとなるセパレースというタンパク質分解酵素の活性化動態の異常が、がん細胞の異数体化を促進する機構に関与していることをつきとめていました(図1)。すなわち、がん細胞では染色体分離開始のはるか前からセパレース活性の漏洩が見られ、その後、急峻な活性化が起きずに低活性化状態のまま染色体分離を開始していました。

図1. がん細胞におけるセパレース活性化動態の異常
セパレースの活性を制御する因子としてセキュリンとサイクリンB1が存在することが知られています。これらの因子がセパレースに結合すると活性が抑制され、セパレースからはずれることで活性化します。セキュリンとサイクリンB1は同時にセパレースに結合することはなく、セキュリンが結合している状態のセパレースとサイクリンB1と結合している状態のセパレースでは構造に違いがあることがわかっていました(図2)。しかし、これらがどのようにして厳重なセパレース活性制御を行い、急峻な活性化を可能にしているかについては不明なままでした。

図2. セキュリンとサイクリンB1によるセパレース活性制御
研究内容
分裂期の染色体分離は、セパレースが姉妹染色分体をつなぎとめているコヒーシンを切断することで引き起こされます。セパレースはこのとき、コヒーシン以外にもセパレース自身を切断する「自己切断」を行うことは知られていましたが、その意義はよくわかっていませんでした。研究グループは、このセパレースの自己切断に着目し、その阻害によってどのような影響がでるかを検討しました。
今回の研究で、セパレースの自己切断を阻害した細胞では非常に重篤な染色体分離エラーが生じることがわかりました。そして、セパレース活性プローブを用いてセパレース活性化プロファイルの解析を行ったところ、がん細胞でみられたようなセパレース活性化動態の異常、すなわち、染色体分離開始のはるか前からセパレース活性の漏洩が見られ、低活性化状態のまま異常な染色体分離を開始していました。
このような活性化動態の異常がなぜ起こるのかについて、さらに検討を進めたところ、以下のことがあきらかになりました。1)セパレースは分裂期の前半はセキュリンによって活性制御を受け、2)その後、染色体分離直前にサイクリンB1が置き換わる形でセパレース活性の早期漏洩を抑制していますが、3)そのときにセパレースの自己切断がサイクリンB1との結合を安定化することでより強固な活性抑制をしていました(図3)。

図3. セパレースの自己切断を介したセパレース活性制御
これらの研究により、セパレースの活性動態の異常を防ぐメカニズムがみいだされ、正確な染色体分離を保証するための機構の理解が深まりました。
今後の展開
がん細胞の多様性が治療を困難にしていますが、その多様性を生み出す原因である染色体分離異常が生じるしくみは多くのがんで共通しています。この共通の性質を治療の標的とすることができれば、多くの進行癌を制御できるようになることが期待され、世界中で盛んに研究され始めています。今回の研究で解明したセパレース活性動態の異常を防ぐための機構は、がん細胞共通の弱点である可能性があり、がんの染色体分離異常に着目した新たな治療法の標的となると考えられます。
5.本研究への支援
本研究は、以下の支援を受けて実施されました。
・文部科学省科学研究費補助金 基盤研究(A)22H00458、基盤研究(C)19K07677ならびに21K07111、若手研究(A)25711003
6.用語解説
(※1)染色体分離
細胞の遺伝情報は染色体という構造体に含まれており、ヒトの細胞には46本の染色体があります。細胞が分裂する前にゲノム情報が複製され、92本の姉妹染色分体と呼ばれる構造体ができますが、お互いのコピーである姉妹の染色分体はすぐには分離せず、コヒーシンと呼ばれる接着因子によって繋ぎとめられています。細胞が分裂して2つの娘細胞ができるときに、このコヒーシンがセパレースと呼ばれるタンパク質分解酵素によって切断され、それぞれの染色体は均等に娘細胞に分配されます。がん細胞ではこの染色体分離過程にエラーが生じて、異数体細胞※2が作りだされています。
(※2)異数体細胞
上述のようにヒトの細胞の染色体数は46本ですが、多くのがん細胞はそこから大きく逸脱した染色体数になっています。このように染色体数が46本以外の多様な本数になっている細胞を異数体細胞と呼びます。染色体は遺伝情報を含んでいますので、その本数がバラバラということは異なる性質を持った細胞、すなわち多様性の高い細胞、が多く存在しているということになります。このようながん細胞の多様性は、がんの治療を難しくする一因となっています。
(※3)セパレース
染色体分離時、姉妹染色分体間のコヒーシンを切断するタンパク質分解酵素です。染色体分離以前には、セキュリンとサイクリンB1が結合することによってセパレース活性は抑制されています。セパレースはコヒーシン以外にもセパレース自身も切断する「自己切断」と呼ばれる活性を持っています。本研究はこの自己切断の意義の解明から発展しました。
関連PDF
- ニュースリリース文書
 (811.0KB )
(811.0KB )