がん化学療法センター分子生物治療研究部長の清宮(せいみや)でございます。当研究部HPをご覧いただき、有り難うございます。
がん化学療法センター分子生物治療研究部長の清宮(せいみや)でございます。当研究部HPをご覧いただき、有り難うございます。
我が国は今や、三人にお一人ががんで亡くなられる時代です。組織を破って浸潤したがん、他臓器に転移したがんの外科的切除は困難なことが多く、究極的な治療手段として化学療法に望みが託されています。俗に「身を切られるような思い」と申しますように、切除可能ながんであっても、その精神的・身体的負担は甚大です。頭痛や発熱に解熱鎮痛剤が効くように、飲んで治るがんの薬があるならば、それはたいへんに素晴らしいことです。
残念ながら、従来のがん化学療法の恩恵は限定的かつ暫時的なものでした。理由は二つあります。一番の問題が、正常組織への副作用です。従来の抗がん剤は、がん細胞の「旺盛な増殖性」を阻止する活性を指標に開発されてきましたので、増殖が盛んな一部の正常細胞に対しても、致死的な障害をもたらしてしまうのです。第二に手ごわいのが薬剤耐性。がん細胞が無秩序かつ無制限に増えて出来た塊(かたまり)の中では、生命進化の縮図とも言うべきカオスが見られます。これは抗がん剤を投与したときも同じです。個々のがん細胞が自身を多様に変化させる性質を身につけることにより、塊の中で一番タフな細胞が繁栄していく仕組みが形成されるのです。再発したがんでしばしば抗がん剤が効かなくなるのは、このためです。そもそも、発がんのプロセスには細胞の老化や死滅が回避されるステップも含まれますので、抗がん剤が最初から効かないがんも少なくありません。
近年、生命科学と様々な技術基盤の発達により、がん生物学は飛躍的な進歩を遂げました。がんは遺伝子に異常が生じて起こる病気であり、遺伝子の格納庫であるDNAの塩基配列を解読することにより、がんの存在や性質を判断出来るようになってきました。がん細胞をがん細胞たらしめている根拠を、分子のレベルで説明出来るようになってきたのです。がんに固有の分子変化をピンポイント攻撃する「分子標的治療」のコンセプトは、このような背景のもとで勃興しました。特異性・奏効性・安全性と三拍子揃った、理想の新療法です。がん細胞の増殖信号をブロックする「キナーゼ阻害薬」や、がん細胞の目印を捕らえて攻撃する「抗体医薬」などが、臨床の場ですでに大きな活躍を見せています。これらの治療成績は、分子標的治療が有用で正しい戦術であることを雄弁に物語っています。ポストゲノム時代を迎えた今、がんの分子個性に応じた個別化医療の発展・普及が期待されます。
しかしながら、分子標的治療薬はその標的特異性の高さゆえに、当該標的分子を持たないがんには適応できない、という点にも気付かなくてはなりません。薬に主体を置いて言うならば、効く患者さんだけを選んで投薬する「選抜化医療」ということになります。真の個別化医療では、全ての患者さんそれぞれに、最適の特効薬が用意される必要があります。がんの多様な分子個性に対応した多彩な新薬シーズの開発、そして既存薬剤の良さをいっそう際立たせる併用療法・集学療法の開発が必要です。
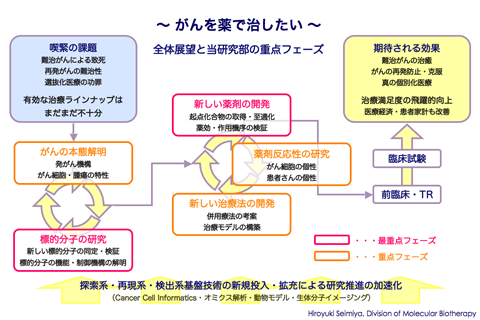
当研究部ではこのような背景を踏まえ、新たながん分子標的治療薬の開発を目指した研究を展開しています。新薬の開発には、基礎的な探索研究から臨床試験まで、長い道のりがあります。私たちは第一に、その起点となるがんの本態解明を目指した基礎研究、そして標的分子の同定からその機能制御機構に関する基礎研究を推進しています。第二に、標的分子の働きを抑える化合物の探索、治療モデルの構築と薬効の検証といった応用研究を進めています。基礎研究には好奇心、応用研究には挑戦心が肝要ですが、両者は氷炭相容れざるものではありません。当研究部には、基礎から応用へとシフトアップしていく大河的な展開や、応用研究から得た知見が基礎研究の意外なブレークスルーとなる面白さが随所に溢れています。最近では、有望な分子標的と想定されるタンキラーゼと呼ばれる酵素の応用研究に端を発し、染色体末端(テロメア)の結合蛋白質が細胞分裂の異常に関与するという、全く新しい基礎生物学的知見も得ています。私たちは、大学とも製薬企業とも一味違う、オリジナルのがん創薬基礎研究を実践すべく、日夜たゆまぬ努力を続けています。
部長 清宮啓之
当研究部の沿革
| 1992年 | がん化学療法センターに分子生物治療研究部が新設される。 濱田洋文博士(現・東京薬科大学生命科学部教授)が部長に就任。 |
|---|---|
| 2000年 | 杉本芳一博士(現・慶應義塾大学薬学部教授)が部長に就任。 |
| 2005年 | 清宮が部長に就任。 |