- HOME
- ����Ɋւ�����
- ����̎�ނɂ���
- �݂���
- �݂���̓��������ÂƐ���
�݂���̓��������ÂƐ���
�݂���̐f�f
1.�݂���̑��ݐf�f
�����݂̈���́A�s�����ۂɂ���Ė����݉����N�������ݔS�����甭�����܂��B���̖����݉�������ƈ݂���������邱�Ƃ�����Ȃ邱�Ƃ�����܂��B���ɁA�݉��Ǝ��Ă��Č����ɂ����݂�����u�݉��ގ��^�݂���v�ƌĂт܂��B����ɁA5mm�ȉ��̔��ɏ������u�����݂���v��������̂�����݂���̈�ł��B
���̂悤�Ȍ����ɂ����݂�������ʓI�ɔ������邽�߂ɁA�������̕a�@�ł́A�������������s����t�̃g���[�j���O�ɓ��ɗ͂����Ă��܂��B���������f�̑S���W�v�ł̈݊��̔�������0.28%(����23�N�x)�ł������A�������̕a�@�ł̐V���Ɍ�����ݎ�ᇂ̔������͖�3%�ƁA���ɍ������������ւ��Ă��܂��B
�݊p��]�̂Q�����̑����݊��i��זE���j�B
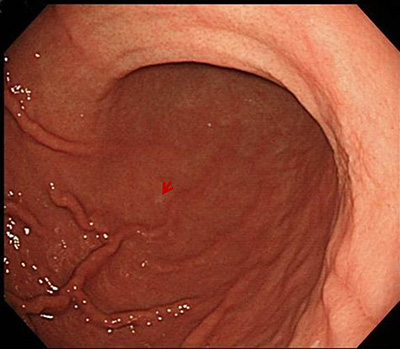
�ݑ̉�����ǂ̂Q������̑����݊��B�w�i�̈݉��������A���̔���������B
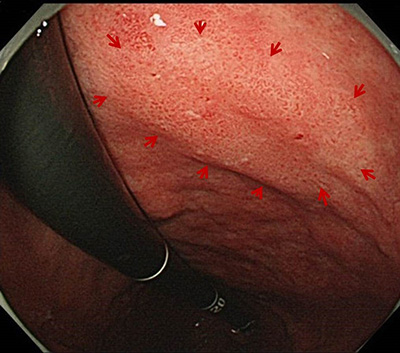
�Q.�݂���͈̔͐f�f
�݂�������Â���O�ɂ́A���ǂ̂��炢�L�����Ă��邩�i�͈͐f�f�j�𐳊m�ɒm�邱�Ƃ���ł��B�������A�����݉����w�i�ɑ��݂���ƁA����̐��m�ȍL�����f�f���邱�Ƃ�����Ȃ邱�Ƃ�����܂��B���̖����������邽�߂ɁA�������͂���̎��͂ɐ��F�̐F�f�i�C���W�S�J���~���j���U�z���Ă��܂��B�C���W�S�J���~�����g���ƁA�݂̓��ǂׂ̍������ʂ��͂�����ƌ�����悤�ɂȂ�A����̂��镔���̍\������薾�m�Ɋώ@�ł��܂��B
����ɁA�݂���̐��m�Ȕ͈͐f�f���s�����߂ɁA�������͐V�����Z�p�ł���g���������NBI�V�X�e�����g�p���Ă��܂��BNBI�Ƃ�Narrow Band Imaging�̗���ł���A���ѐ��t�B���^�[��d�q�X�R�[�v�̃V�X�e���ɑg�ݍ��ނ��Ƃɂ��A����Ȍ����g���A�S���\�ʂ��ڍׂɊώ@���邱�Ƃ��ł��܂��B�g���������NBI�p���邱�Ƃɂ��A���̕\�ʂ��ő�80�{�܂Ŋg�債�āA����͈̔͂𐳊m�ɐf�f���邱�Ƃ��ł��܂��B���̍��x�ȋZ�p�ɂ��A�������͈݂���͈̔͂���萳�m�ɔc�����邱�Ƃ��ł��܂��B����́A���Âɑ傫�ȗ��_�������炵�܂��B���m�Ȑf�f�ɂ��A�K�v�ȏ�ɑ����̌��N�ȕ�������菜�����ƂȂ��A�܂��A������c�����ɓK�Ȕ͈͂Ő؏����邱�Ƃ��\�ɂȂ�܂��B
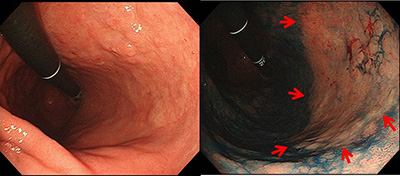
�R.�݂���̐[�B�x�f�f
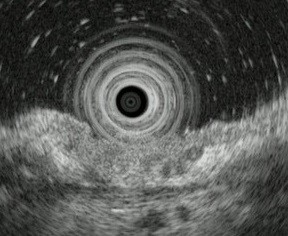
���Õ��j�����肷�邤���ŁA���̐[���i�[�B�x�j�̐f�f���K�v�ł��B�ʏ�̓����������ł͔��f������Ƃ��ɁA�������̐悩�璴���g���o���@�B�i�����g�������j���g�p���A���̐[�B�x�f�f�̐��x�̌���ɖ𗧂ĂĂ��܂��B
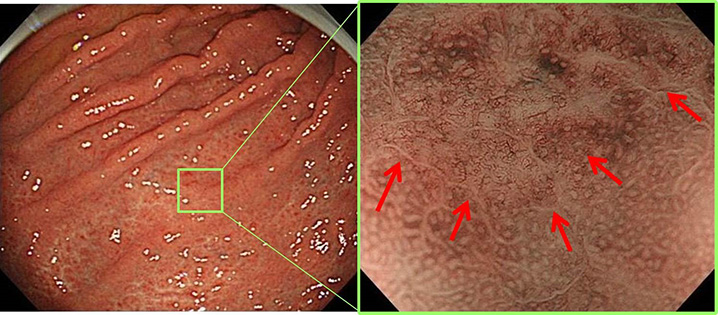
�����݂���̓���������
�����݂�������Â��邽�߂̓��������Âɂ́A��̕��@������܂��B��ڂ́u�������I�S���؏��p�iEMR�j�v�A������́u�������I�S�����w�����p�iESD�j�v�ł��BEMR�͔�r�I�V���v���Ȏ�@�ł����A�傫�ȕa�ς́A�����Ő؏�����邱�Ƃ�����A���̕��@�ł́A���Ì�ɂ��Ĕ����邱�Ƃ��A��5%-10%�̊m���ł���܂��B����AESD�́A�傫�Ȃ���ł��A��x�̎��ÂŊ��S�Ɏ�菜�����Ƃ��ł��܂��B���̂��߁A���Ì�ɂ��Ǐ��Ĕ����郊�X�N�͔��ɒႢ�ł��B2006�N4������A���{�ł�ESD���ی��K�p�̎��Õ��@�Ƃ��ĔF�߂��A�L���s����悤�ɂȂ�܂����B���@�ł��݂���̓��������ẤAESD����I���ɂ��Ă��܂��B
���@�ł́A�L���a�@�J�@�ȗ��A��5000��ȏ�̑����݂���ɑ���ESD���s���Ă��܂����B�����ł́A�����݂���ɑ�����������Â̓K���A��̓I�Ȏ��Õ��@�A���Ð��сA�����ǂȂǂɂ��Đ������܂��B
1.�����݂���ɑ�����������Â̓K��
�����݂���̓��������ẤA���ݕǂ̐w�Ɍ��肳��Ă���ꍇ�ɓK�p����܂��B�܂��A���������Âł́A�݂̊O���̃����p�߂�؏����邱�Ƃ͂ł��Ȃ��̂ŁA�����p�ߓ]�ڂ̉\�������Ȃ�Ⴂ�ƍl�����Ă���a�ς����������Â̓K���ƂȂ�܂��B
��̓I�ȓ��������Â̓K�����ȉ��Ɏ����܂��i�݊����ÃK�C�h���C����6�ł̓��������Â̐�ΓK���a�ρj�B
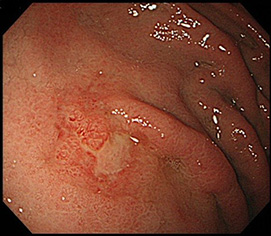
- �S��������A�����^���A��ᇂȂ��i�傫���ɐ����Ȃ��j���ʐ^�P
- �S��������A�����^�A��ᇂ���i3cm�ȉ��j���ʐ^�Q
- �S��������A�������^�����A��ᇂȂ��i2cm�ȉ��j���ʐ^�R
�������^�F�������Ō��Ĉ݂̐���̔S���Ɏ����ł܂����邪��
�����������^�F�������Ō��Ă���זE���ł܂�����Ȃ�����
���̑��̕a�ςł��A���҂���̌��N��ԁA�N��Ȃǂ��l�����āA���������Â̓K�����L���邱�Ƃ�����܂��B
-
�ʐ^�P�F44mm�̕����^�S��������A��ᇂȂ� 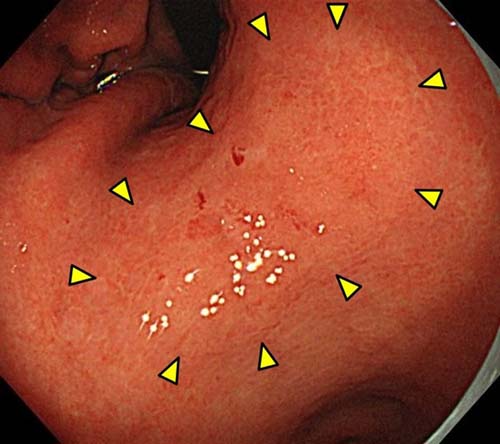
-
�ʐ^�Q�F20mm�̕����^�S��������A��ᇁiፍ��j���� 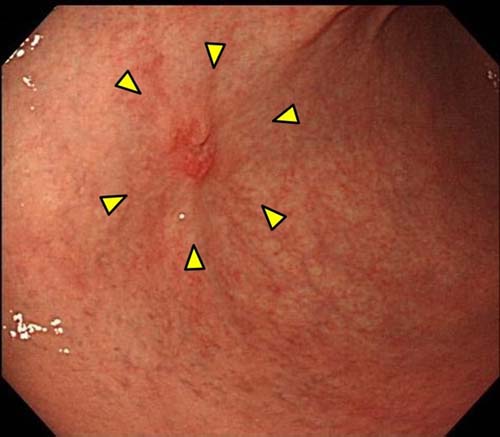
-
�ʐ^3�F20mm�̖������^�S��������A��ᇂȂ� 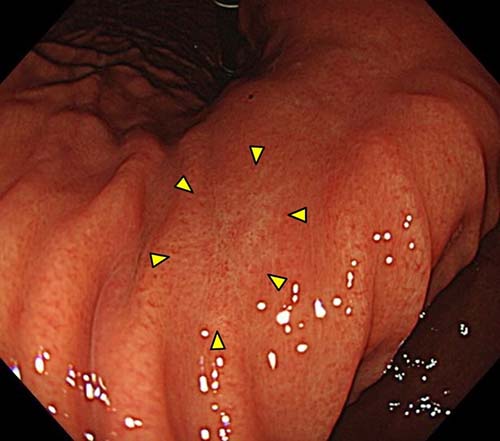
2.�����݂����ESD�菇
�����݂���ɑ���ESD�̎�Z�ɂ��āA�ʐ^���g���Đ������܂��B���̎��Âɂ����鎞�Ԃ́A����̈ʒu��傫���ɂ���ĈقȂ�܂��B�����Ȃ���̏ꍇ�A1���Ԓ��x�ł��B�������A���傫��������A��ᇂ���������A�o�������������肷��ƁA2���Ԉȏ�K�v�Ȃ��Ƃ�����܂��B
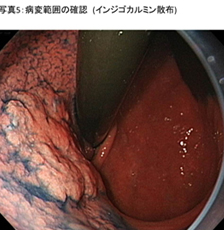
- �a�ϔ͈͂̊m�F (�ʐ^5)
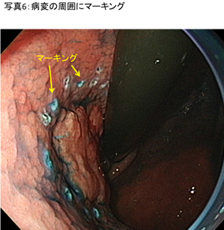
�C���W�S�J���~����|�_�̎U�z�ANBI�iNarrow Band Imaging�F����Ȍ���p�����Z�p�j�𗘗p�����g����������g�p���āA�a�C�͈̔͂��m�F���܂��B - �a�ώ��͂̃}�[�L���O (�ʐ^6)
�a�ς����2�~�����[�g���O���Ɉ�����܂��B����́A�a�ς�؊J����ۂ̃K�C�h�ƂȂ�܂��B
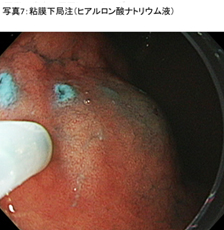
- �S�����Ǐ����ˁi�q�A�������_�j (�ʐ^7)
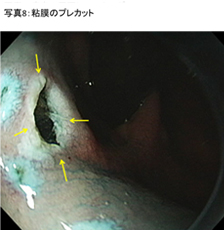
���ːj��S�����w�Ɏh���A�q�A�������_�i�C���W�S�J���~�������������́j�𒍓����܂��B����ɂ��A�S�����w������オ��A�ؑw�������邱�Ƃ�h�����Ƃ��ł��܂��B - �S���̃v���J�b�g (�ʐ^8)
�j��̓d�C���X�ŔS���̈ꕔ��؊J���܂��B�������镔�����S�����w�ł��B
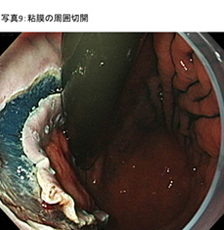
- �S���̎��͐؊J (�ʐ^9)
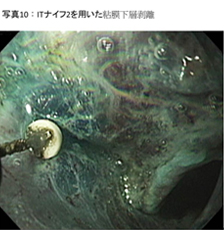
����ȓd�C���X�iIT�i�C�t2®�Ȃǁj���g�p���āA�}�[�L���O�̊O����S���ɂ킽��؊J���܂��B - �S�����w�̔��� (�ʐ^10)
�q�A�������_������ɔS�����w�ɒ������Ă���A�d�C���X��p���ĔS�����w��T�d�ɔ������܂��B
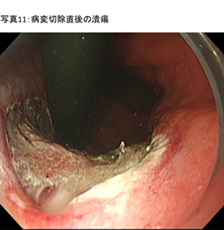
- �a�ϐ؏���̏��u (�ʐ^11)
�a�ς���菜������̒�ᇕ����Ɍ��ǂ�������ꍇ�A���ǂ��Ď܂�����A�N���b�v���������肵�܂��B���̏��u�ɂ��A���Ì�̏o�����X�N�����炵�܂��B����ŁA���Â������ł��B
���ۂ�ESD��Œ��܂��B(����Q��)
�Ǘ�1�F
�ݑ̏㕔���]�A30mm�A0-�Ua�^�A�������Ǐ�B����
�Ǘ�2�F
�݊p����]�A30mm�A0-�Ub+�Uc�^�A�������Ǐ�B��
3.�����݂���̓��������Ì�̕a���]��
���������ÂŐ؏������݂���ɂ��Ă͕a���f�f���s���܂��B���̕a���f�f���ʂ��A����̍ŏI�f�f�ƂȂ�܂��B�މ@���3�T�Ԍ�̊O���ŁA�a���f�f�̌��ʂ�������܂��B�a���f�f�̌��ʁA�����S�ɐ؏�����A�����p�߂ւ̓]�ڂ��قڍl�����Ȃ��i�����؏��j�Ɣ��f���ꂽ�ꍇ�́A����I�Ȍo�ߊώ@�Ɉڍs���܂��B����A�����p�ߓ]�ڂ̉\�����c��Ɣ��f���ꂽ�ꍇ�́A���̃��X�N��������A�lj��̊O�Ȏ�p�i�݂̈ꕔ�܂��͂��ׂĂ̐؏��ƃ����p�߂̐؏��j���邩�ǂ����ɂ��Ċ��҂���Ƒ��k���܂��B
�S.���@�̑����݂���ESD�̎��Ð���
���@��2005�N6������2024�N12���̊��Ԃ�ESD���{�s���������݂���A�ݑB��7,209��̎��Ð��т������܂��B
| �ꊇ�؏���
(�a�ς��ꊇ�Ő؏����ꂽ�Ǘ�) |
99.2% (7,152/7,209) |
| �ꊇ���S�؏���
�i�a�ς��ꊇ�؏�����A���؏��f�[���A���̏Ǘ�j |
96.1% (6,926/7,209) |
| �����؏���
�i�a�ς��ꊇ���S�؏�����A���K���g������Ɉ�v�����Ǘ�j |
85.6% (6,174/7,209) |
| ���Î��Ԓ����l
�i�������}������~�����u�����܂ł̑S�̂̎��ԁj |
70�� |
| ������ | ��o�� 2.4% (180/7,209) ���E 0.7% (51/7,209) |
ESD�̎�Z�ł́A�a�ς���x�ɂ܂Ƃ߂Đ؏����邱�Ɓi�ꊇ�؏��j���ł��A���̕��@�ɂ��ڍׂȕa���]�����\�ɂȂ�܂��BESD�ɂ�鎡���؏�����86.0%�ł����B�܂�A��15%�̕a��ł͎����؏��ɂ͂Ȃ�܂���B�����āA�lj��̊O�Ȏ�p�A��̓I�ɂ̓����p�߂���菜���ݐ؏��p���K�v�ƂȂ�ꍇ������܂��B����́A���������ÑO�̕]���ł͔S�����ɗ��܂�Ɣ��f���ꂽ�a�ςł����Ă��AESD��̕a���f�f�ŁA����זE���\�z�ȏ�ɐ[���S�����w�ɐZ�����Ă��邱�Ƃ������������߁A���������Â����ł͊��S�ɂ͎�菜���Ă��Ȃ��Ƃ����P�[�X�Ȃǂ����邽�߂ł��B
�T.�����݂�����������Ì�̌o�ߊώ@
���������Âɂ���Ĉ݂����S�Ɏ�菜����Ă��A���̌�Ɏc�����݂̔S���ŐV���Ȉ݂���������邱�Ƃ�����܂��B���N��1�`3���̊����ŐV�����݂�������\�������邽�߁A����I�ȃt�H���[�A�b�v���d�v�ł��B���̂��߁A�N��1��͓������������邱�Ƃ���������܂��B
���@�ł͓���@�\�a�@�i���x�Ȉ�Â�������ȕa�@�j�Ƃ���������A���Ì�̒���I�Ȍo�ߊώ@�͒ʏ�A�Љ���������N���j�b�N�ōs���܂��B���җl�ɂ͈��S���ăt�H���[�A�b�v���p�����Ă����������߂ɁA�M���ł���N���j�b�N���Љ�邱�Ƃ��\�ł��B���Ì�̌o�ߊώ@�ɂ��ĕs���⎿�₪����A�O���ł��C�y�ɂ����k���������B
�݂���̓��������Â̐���
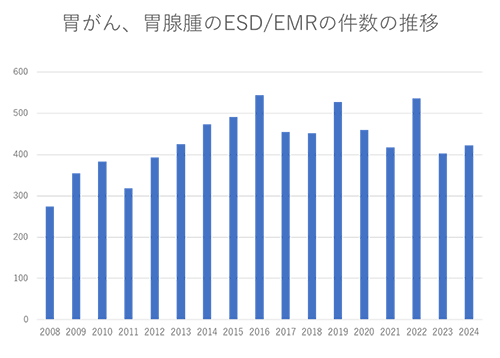
���@�ł݂̈���шݑB��̓������I�؏��p(EMR/ESD)�̎��Ê��Ґ���}�Ŏ����܂��B���ߐ��N�̎��Ì����́A2020�N�ɂ�460���A2021�N�ɂ�417���A2022�N�ɂ�536���A������2023�N�ɂ�403���̎��Â��s���܂����B�X�^�b�t�������������E���J�o���[���̑��݂ɂ��A���f���玡�ÊJ�n�܂ł̊��Ԃ�2�`4�T�Ԓ��x�ɒZ�k���邱�Ƃ��ł��Ă��܂��B
���ׂĂ̑����݂����������ÂŎ�����킯�ł͂���܂���B���@�ł͎��ÑO�Ɉ݂���̕a���₪��זE�̑g�D�^�i�������Ō������̍זE�̗l�q�j�A�S�g��ԂȂǂ��J���t�@�����X�ŏڂ����������܂��B���̉�c��ʂ��āA���҂���ɂƂ��Ă̍œK�Ȏ��Â����߂Ă��܂��B�O���ł͎厡�ォ��A�J���t�@�����X�̌��ʂ����ƂɊ��җl��l�ЂƂ�ɍ��������Õ��@������Ă��܂��B�����āA���҂���ƈꏏ�Ɏ��Õ��j�����肵�܂��B