がんと遺伝
がんの遺伝と遺伝性腫瘍 | 遺伝性乳がん卵巣がん(HBOC) | リンチ症候群(Lynch症候群) | リー・フラウメニ症候群 | 家族性大腸腺腫症(FAP) | 遺伝性腫瘍の遺伝子検査(遺伝学的検査)
遺伝性のがんの可能性があるかどうかは、遺伝カウンセリングで詳しい病歴や家族歴を確認しながら検討していきます。遺伝カウンセリングや遺伝学的検査が必要かどうか、オンラインでも相談することができます。 詳しくはこちら
目次
Chapter.1: がんの遺伝と遺伝性腫瘍
-
現在、日本人の2人に1人が生涯のうち1度はがんに罹患するといわれています。男女別で見ると、男性が62.1%、女性は48.9%です(がん情報サービスより)。ご家族の中にがん患者さんがいる方は珍しくはありません。
がんの原因には環境要因(年齢、お酒、タバコ、ウイルスなど)と遺伝要因があり、多くは環境要因が原因であるといわれています。例えば大腸がんの場合、遺伝要因が強く関わっていると考えられるがんは5〜10%程度とされています。

- 人のからだには2万種類以上の遺伝子があり、それぞれ違ったはたらきをしています。その中には、がんの発症に関わっている遺伝子もあります。遺伝要因とは、このようながんの発症しやすさに関わる遺伝子に生まれつき変化を持っているときで、「遺伝性腫瘍症候群(遺伝性のがん)」といいます。どの遺伝子に変化があるかによって、発症しやすいがんの種類や、がんの発症率は異なります。以下に遺伝性腫瘍症候群の一例を示します。
名称 遺伝子 関連するがん 遺伝性乳がん卵巣がん
(Hereditary Breast and Ovarian Cancer; HBOC)BRCA1, BRCA2 乳がん、卵巣がん、前立腺がん、膵がん、 悪性黒色腫 リンチ症候群
(Lynch症候群)MLH1, MSH2, MSH6, PMS2 (EPCAM) 大腸がん、子宮体がん、胃がん、
尿路系上皮がん、卵巣がん など家族性大腸腺腫症
(Familial Adenomatous
Polyposis; FAP)APC 大腸がん(ポリポーシス)、十二指腸がん、
胃がん、甲状腺がん などリー・フラウメニ症候群
(Li-Fraumeni症候群、LFS)TP53 軟部組織肉腫、骨肉腫、脳腫瘍、
副腎皮質がん、乳がん(閉経前が多い) などカウデン症候群
(Cowden症候群)PTEN 乳がん、子宮体がん、甲状腺がん、
大腸がん、腎細胞がん など遺伝性びまん型胃がん
(Hereditary Diffuse Gastric
Cancer; HDGC)CDH1 びまん型胃がん(印環細胞がん)、
乳がん(小葉がん) など - 遺伝学的検査 によって、上記のような遺伝性腫瘍症候群に関連する特定の遺伝子に生まれつきの変化を持っているか調べることができます。遺伝性腫瘍症候群と診断された場合にはその体質に合わせた対策(より細やかな検診や予防的な治療)を実施していくことで、がんの予防や早期発見を目指します。
-
どのような場合に遺伝性腫瘍症候群の可能性を考えるのでしょうか?
遺伝性腫瘍症候群の場合、ご本人の病歴やご家族の病歴に、次のような特徴があることがあります。
- 若くしてがんに罹患した方がいる
- 家系内に複数回がんに罹患した方がいる
- 家系内に特定のがんが多く発症が多い
- 遺伝性腫瘍症候群は、遺伝学的検査の結果、特定の遺伝子にがんの発症に関係する生まれつきの変化(病的バリアントといいます)が見つかることで診断されます。(遺伝性腫瘍の中には、遺伝学的検査を実施しなくても、臨床症状で診断できるものもあります。)
- 遺伝カウンセリングでは、個々の状況に応じて、遺伝性腫瘍症候群に関する情報の提供、遺伝学的検査や病的バリアントが認められた場合の具体的ながん対策のマネジメント、血縁者への影響などについて話し合います。
- 次から、遺伝性腫瘍症候群のうち、遺伝性乳がん卵巣がん(HBOC)、リンチ症候群(Lynch症候群)、リー・フラウメニ症候群 、家族性大腸腺腫症(FAP) の4つの体質について少し詳しくご説明します。
Chapter2 ①遺伝性乳がん卵巣がん(Hereditary Breast and Ovarian Cancer: HBOC)
-
遺伝性の乳がんや遺伝性の卵巣がんの原因遺伝子はいくつか明らかになっており、その中でも、最も代表的なものがBRCA1とBRCA2の2つの遺伝子です。BRCA1あるいはBRCA2遺伝子に、がんの発症と関係する変化(専門用語で病的バリアントと言います)があった場合に、遺伝性乳がん卵巣がん(HBOC)と診断されます。
-
乳がん患者さんのうち、BRCA1またはBRCA2の病的バリアントを持つ方は4%、卵巣がん患者さんでは10-15%と報告されています。

<HBOCのがん発症リスク>
- HBOCの場合、乳がん、卵巣がん、前立腺がん、膵がんなどの発症リスクが一般リスクと比較して、高いことがわかっています。HBOCでは、一般の乳がんに比べて、発症年齢が低く、両側の乳房に発症する頻度が高い(35%) などの傾向が見られます。
がんの種類 日本人一般 欧米人一般 病的バリアントがある遺伝子 BRCA1 BRCA2 乳がん (女性) 10.6% 12.90% 46‾87% 38‾84% 乳がん (男性) 0.1%(欧米) 0.1% 1.2% 最大8.9% 卵巣がん 1.6% 1.2% 39‾63% 16.5‾27% 前立腺がん 10.8% 12.5% ‾29% ‾ 60% 膵がん 2.6%(男性) 2.5%(女性) 1.7% 1‾3% 2‾7% 悪性黒色腫
(皮膚・眼)2.3% リスク上昇 -
上記はあくまで確率ですので、BRCA1またはBRCA2の病的バリアントを持っていても、生涯、がんを発症しない方もいらっしゃいます。
<HBOCの遺伝学的検査>
-
BRCA1/2遺伝学的検査ではBRCA1またはBRCA2に生まれつきの病的バリアントがあるか採血して調べます。
BRCA1/2遺伝学的検査は、乳がん、卵巣がん、前立腺がん、膵臓がんの治療薬の1つ、PARP阻害薬の適応を判断する目的で行う場合に加えて、2020年4月より、HBOCの診断目的として行う場合も一部、保険診療として実施されるようになりました。下記の表に当てはまる場合は、保険診療内でBRCA1/2遺伝学的検査を受けることができます。
表. 保険診療でBRCA1/2遺伝学的検査の対象となる場合
- 45歳以下で乳がんと診断された
- 60歳以下でトリプルネガティブの乳がんと診断された
- 2個以上の原発性乳がんと診断された
- ご自身が乳がんと診断されて、かつ第3度近親者内(父母、兄弟姉妹、子ども、祖父母、おじ・おば、異母・異父の兄弟姉妹、孫、甥・姪、いとこ、祖父母の兄弟姉妹)に乳がんまたは卵巣がんまたは膵がんと診断された方がいる
- 卵巣がん・卵管がん・腹膜がんと診断された
- 乳がんと診断された男性
- がんと診断され、PARP阻害薬の治療の適応を判断する目的でBRCA1/2遺伝学的検査を行う場合
<HBOCと診断されたら>
- 当院ではHBOCと診断された方に対する対策として、主に乳腺科・婦人科と連携して定期的なサーベイランス(がんのリスクが高いと考えられる臓器に対してきめ細かく計画的に行う検査。一般的ながん検診とは異なります。)やリスク低減手術を行っています。
乳房のサーベイランス 18才〜 自己触診を行う 25-29才 医療機関で半年〜1年毎の頻度で視触診(エコー)
1年毎の造影乳房MRI検査30-75才 医療機関で半年〜1年毎の頻度で視触診
1年毎の造影乳房MRI検査とマンモグラフィとエコー75才以上 個別に相談 「リスク低減乳房切除術(RRM)」
(乳がんのリスクを下げるために、がんを発症する前に乳房を切除する手術)の選択について、医療者と話し合う卵巣のリスク低減手術 「リスク低減卵管卵巣摘出術(RRSO)」
リスク低減卵管卵巣摘出術(卵巣がんのリスクを下げるために、がんを発症する前に両方の卵巣および卵管を切除する手術)が、出産を終えた後、典型的には35〜40歳で受けることが推奨される
*BRCA2に病的バリアントがある場合は、卵巣がんの発症年齢が8〜10年遅いため、40〜45歳まで延期してもよい。 -
卵巣がんは有効な検診方法がなく、早期発見が難しいため、妊娠・出産を終えた後に、卵巣及び卵管を予防的に切除することが推奨されます。
<HBOCの遺伝>
- HBOC(BRCA1あるいはBRCA2遺伝子の病的バリアント)は、50%の確率で親から子どもに受け継がれます。HBOCと診断された方の血縁者の方は、がんを発症していなくても、遺伝学的検査によってHBOCの体質かどうかを調べることが可能です。
| まとめ:遺伝性乳がん卵巣がん(HBOC) |
|---|
|
- (詳細は専門医にご相談ください;参考文献:NCCN Guidelines®, Genetic/Familial High-Risk Assessment: Breast, Ovarian, Pancreatic, and Prostate. Version3.2025)
Chapter3 ②リンチ(Lynch)症候群
-
MLH1、MSH2、MSH6、PMS2の4つのミスマッチ修復遺伝子(MMR遺伝子)*のうちの1つ、もしくはMSH2遺伝子の近くに存在するEPCAM遺伝子に、生まれつきがんの発症に関係する変化(病的バリアント)がある場合、リンチ症候群(Lynch症候群)と診断します。
*ミスマッチ修復遺伝子(MMR遺伝子):細胞が増殖する際、すでに細胞内にある遺伝子をコピーし、新しく作られた細胞へ分配しますが、ときおり間違ったコピーが作られることがあります。MMR遺伝子は、その間違いを修復する役割を担う遺伝子です。
-
以前は、遺伝性非ポリポーシス性大腸がん(Hereditary non-Polyposis Colorectal Cancer : HNPCC)という名称も使われていましたが、今ではこの遺伝性腫瘍を最初に報告した米国のヘンリー・リンチ博士の名前にちなんで「リンチ症候群」と呼ぶことが多くなっています。
-
リンチ症候群の割合は、大腸がん患者さんの2〜4%、子宮体がん患者さんの0.5〜3.5%と報告されています。
- 海外の報告では、リンチ症候群の割合は、大腸がん患者さんの2〜4%、子宮体がん患者さんの0.5〜3.5%と報告されています。
- リンチ症候群の原因となる遺伝子の病的バリアントは、親から子どもへ50%の確率で受け継がれますので、家系内にリンチ症候群がある場合、各世代にリンチ症候群関連がんと診断された方がいらっしゃることがあります。

<リンチ症候群でのがん発症リスク>
リンチ症候群では大腸がん、子宮体がん、胃がん、卵巣がん、腎盂・尿管がんなどのがんの発症リスクが一般リスクより高くなるとされています。下記がリンチ症候群での主ながん発症リスクです。
| *:海外のデータを使用 | 一般リスク (〜79歳) |
70歳までの累積がん発症リスク(%) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| MLH1 | MSH2 | MSH6 | PMS2 | EPCAM | ||||||
| 男性 | 女性 | 男性 | 女性 | 男性 | 女性 | 男性 | 女性 | 男女 | 男女 | |
| 全体 | 62.1 | 48.9 | 64 | 78 | 71 | 77 | 28 | 62 | 22 | |
| 大腸 | 9.7 | 7.8 | 53 | 44 | 46 | 42 | 12 | 20 | 3 | 75 |
| 子宮体部 | 2.1 | 35 | 46 | 41 | 13 | 12 | ||||
| 卵巣 | 1.5 | 11 | 17 | 11 | 3 | |||||
| 胃 | 8.9 | 4.2 | 16 | 8 | 16 | 10 | 4 | 2 | 4 | |
| 小腸 | <1* | |||||||||
| 尿管・腎臓 | <1* | 4 | 3 | 16 | 13 | 2 | 6 | |||
| 膀胱 | <1* | 5 | 3 | 9 | 7 | 4 | 1 | |||
- リンチ症候群と診断された方の大腸がんは、原因遺伝子によって、大腸がんを発症するリスクと平均発症年齢が異なることが報告されています。そこで、リンチ症候群と診断された場合の大腸サーベイランスの開始年齢を個別に 考えるようになりました(「リンチ症候群と診断された場合の対策」参照)。
- リンチ症候群と診断された方の全てががんを発症するのではありませんが、一般より高いがん発症リスクを考慮し、通常のがん検診とは異なる対策が推奨されています。(「リンチ症候群と診断された場合の対策」参照)
<リンチ症候群と診断された場合の対策>
- リンチ症候群と診断された方に対して、当院では消化器科や婦人科などの診療各科が連携して対応しています。がんのリスクが高いと考えられる臓器に対しては、早期の段階でがんを発見して、治療できるような計画的なサーベイランスが有効であると考えられています。また、一般にリンチ症候群の大腸がんの予後(手術などの治療成績)は良好であることを示す臨床データも複数報告されています。
- リンチ症候群と診断された方に対しては、国際的なガイドラインおよび日本のガイドラインを参考にして、遺伝学的検査の結果(病的バリアントを有する遺伝子の種類)や家族歴などの個々の状況に合わせて、担当医が必要と判断した検査を提案し、ご本人と計画していきます。
| 部位 | 開始年齢 | サーベイランス |
| 大腸 | MLH1, MSH2:20-25歳 MSH6:30-35歳 PMS2:30-35歳 |
1-2年毎に大腸内視鏡 PMS2:1-3年毎に大腸内視鏡 |
| 子宮 | 30-35歳 | 1-2年毎に子宮内膜組織診(または細胞診) |
| 卵巣 | ― | 経腟超音波検査、腫瘍マーカー(CA-125) |
| 胃・ 十二指腸 |
30-35歳 | 家族歴や年齢、ピロリ菌の感染の有無、 胃病変の有無を考慮して上部消化管内視鏡 |
| 尿路 | 30-35歳 | 遺伝子や家族歴、健康診断の結果などを 参考にして、検尿または尿細胞診 MSH2に病的バリアントがある場合、 または尿路系上皮癌の家族歴がある場合に考慮 |
| 膵臓 | 50歳 | 膵癌の家族歴を考慮して、 肝胆膵内科と連携した定期検査 |
<リンチ症候群を診断する検査と手順>
- リンチ症候群の可能性を調べる検査
がんを発症した方が遺伝学的検査を実施する前に、手術や内視鏡検査で摘出した腫瘍組織を使い、リンチ症候群の可能性を調べることができる2つの検査があります。これらの検査は、リンチ症候群の可能性を知る検査であり、リンチ症候群と診断することはできません。 これらの検査でリンチ症候群の可能性があると考えられた場合に、確定診断のための遺伝学的検査(後述)を考慮します。
- マイクロサテライト不安定性(MSI)検査
MSI検査は、薬剤の適用を判断する目的、あるいはリンチ症候群のスクリーニング検査*として実施されます。MSI検査は、リンチ症候群が疑われる患者さんであれば保険診療にて実施可能です(2025年3月現在)。費用は3割負担の場合、約7,500円です。この検査の結果、陽性(MSI-H)であった場合、リンチ症候群の遺伝学的検査(確定するための検査)を考慮します。
*リンチ症候群が疑わしいかどうか調べる検査 - ミスマッチ修復タンパクの免疫組織化学染色(MMR-IHC検査)
MMR-IHC検査も、リンチ症候群のスクリーニング検査です。この検査では、手術等で摘出した腫瘍組織を染色することで、4つのMMR遺伝子の中に働きが失われているものがないかを調べることができます。私たちの体内では、遺伝子の情報をもとに、体内で必要なタンパクを作っています。MMR遺伝子からはMMRタンパクが作られていますが、働いていないMMR遺伝子からは、そのMMRタンパクが作られず、MMR-IHC検査では染色されません。MMR-IHC検査は、摘出した腫瘍組織を染色し、4 つのMMRタンパクが作られているかを見ることで、働いていないMMR遺伝子がないか、どの遺伝子が働いていないかを見ることできます。(下図)
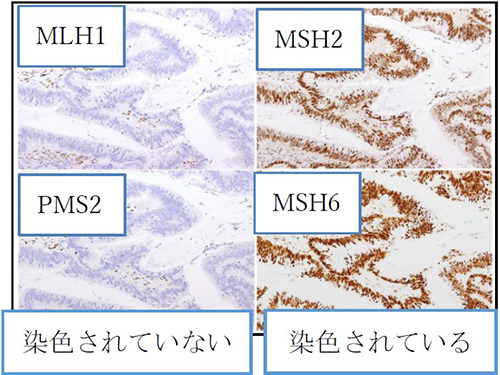 また、MMR-IHC検査もMSI検査と同様に薬剤の適応を判断する目的で検査されることがあります。どの目的で検査を実施するかで、費用が異なります。薬剤選択の目的でMMR-IHC検査を実施し、染色が消失している組織が認められた場合もリンチ症候群の可能性がありますので、遺伝学的検査での確定検査を検討します。
また、MMR-IHC検査もMSI検査と同様に薬剤の適応を判断する目的で検査されることがあります。どの目的で検査を実施するかで、費用が異なります。薬剤選択の目的でMMR-IHC検査を実施し、染色が消失している組織が認められた場合もリンチ症候群の可能性がありますので、遺伝学的検査での確定検査を検討します。
- マイクロサテライト不安定性(MSI)検査
- リンチ症候群の確定診断=遺伝学的検査
-
リンチ症候群と診断するには、血液を採取し、MLH1 、MSH2、MSH6、PMS2、EPCAMの5つの遺伝子の遺伝学的検査を実施することが必要です。遺伝学的検査によって、いずれか遺伝子に病的バリアントが認められた場合にリンチ症候群と診断します。
- リンチ症候群と診断された方の血縁の方は、がんを発症していない状態であっても遺伝学的検査を実施し、リンチ症候群と診断された場合にはサーベイランスを実施することが推奨されています。
-
| まとめ リンチ(Lynch)症候群 |
|---|
|
(詳細は専門医にご相談ください)
参考文献
- 大腸癌研究会 遺伝性大腸癌診療ガイドライン2024年度版
- NCCN Clinical Practice Guideline in Oncology Genetic/Familial High-Risk Assessment: Colorectal, Endometrial, and Gastric Version4.2024
- GeneReviews Japan: http://grj.umin.jp/grj/lynch.htm リンチ症候群
GeneTests Medical Genetics Information Resource (database online). Copyright, University of Washington, Seattle. 1993-2015. Available at http://www.genetests.org. Accessed [March, 31th, 2023].
Chapter4 ③リー・フラウメニ(Li-Fraumeni)症候群
-
TP53遺伝子に生まれつきがんの発症に関係する変化(病的バリアント)がある場合、リー・フラウメニ症候群と診断されます。TP53遺伝子は私たちのからだでの中でがん発症を抑えるはたらきをしている大事な遺伝子ですが、この遺伝子が変化してうまく働かないことにより、がんを発症しやすくなると考えられています。
-
この疾患を見つけたフレドリック・リー先生とジョセフ・フラウメニ先生の名前を取って命名されました。
<リー・フラウメニ症候群でのがん発症リスク>
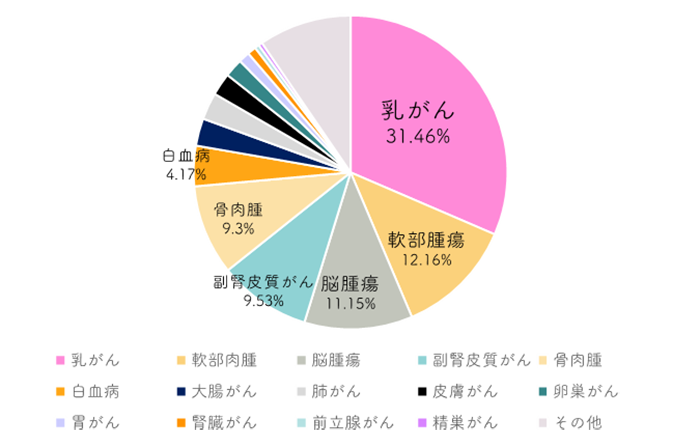
- 下記のグラフは、リー・フラウメニ症候群と診断された2,591名を調べたデータであり、発症した がんの種類、またその がんの全てのがん種に対する割合(%)を示しています。
TP53の病的バリアントを持つ2591人を調べたデータ
(©IARC TP 53 Database, R20, July 2019のグラフを改変)
-
リー・フラウメニ症候群によって生じるがんは、軟部肉腫や骨肉腫、乳がん、脳腫瘍、副腎皮質がん、白血病、肺がん、消化器のがん、その他、子どもから大人まで様々な種類におよび、中には非常にまれな種類のがんも含まれます。リー・フラウメニ症候群と診断された女性では乳がんが最も多いがんであると報告されています。
<リー・フラウメニ症候群と診断されたら>
-
リー・フラウメニ症候群と診断がついた場合、下記のような計画的なサーベイランスを実施していきます。
- 全体的な身体の診察
- 何か医学的に気になることがあれば、いつでもできるだけ早めに相談する
乳がん 自己触診、医療機関での乳房診察(年2回)、乳房MRI(年1回) 脳腫瘍 脳MRI(年1回) 骨軟部腫瘍 全身MRI(年1回) 消化管腫瘍 上部・下部内視鏡検査(2年〜5年に1回、25才から) -
また、リー・フラウメニ症候群の場合、放射線を浴びることで2次がんのリスクが高まるため、放射線治療やCT検査などの計画について担当医が配慮して検討します。
<リー・フラウメニ症候群の遺伝学的検査を検討する基準>
-
下記のような特徴がある場合に、リー・フラウメニ症候群の遺伝学的検査を検討します。
古典的LFS診断基準(以下の全てを満たす場合、リー・フラウメニ症候群と診断) - 発端者が45才未満で肉腫と診断
- 第 1 度近親者(親、子、兄弟姉妹など)に 45 才未満で種類を問わず悪性腫瘍と診断された人がいる
- 第 1 ・第 2 度近親者(親、子、兄弟姉妹、祖父母、孫、異父母兄弟姉妹、おじ、おば、姪、甥など)に 45 才未満で悪性腫瘍と診断された人がいる、
または、年齢を問わず 肉腫と診断された人がいる
ChompretのTP53スクリーニングの基準(いずれかに該当する場合遺伝学的検査を検討) - 【家族歴】(以下の全てを満たす)
-
- 発端者が46才未満でLFS*コア腫瘍(乳がん、骨軟部肉腫、副腎皮質がん、脳腫瘍)と診断
- 第 1 あるいは第 2 度近親者の少なくとも1人が56才未満でLFSコア腫瘍の既往がある
- 発端者が乳がんの場合は、乳がんと診断されている近親者は除外する
- 【多重がん】
-
- 発端者が多重がん(両側乳がんを除く)と診断されており、そのうち2種類がLFSコア腫瘍で、46才未満で最初のLFSコア腫瘍と診断
- 【希少がん】
-
- 副腎皮質がん、脈絡叢がん、退形成亜型横紋筋肉腫の患者
- 家族歴は問わない
- 【若年乳がん】
-
- 31才未満の乳がん患者
その他:リー・フラウメニ症候群の可能性を考える場合 - 小児期発症低二倍体急性リンパ性白血病と診断された方
- 腫瘍組織の検査でLFSが疑われた方
*LFS:リー・フラウメニ症候群(Li-Fraumeni症候群)
-
上記のように、ご本人、または血縁者が若い年齢で様々な種類のがんと診断されている場合、リー・フラウメニ症候群の可能性を考えます。リー・フラウメニ症候群の場合、小児期からがんを発症する可能性があります。
-
また、上記のChompret基準の【若年乳がん】の項目のように、リー・フラウメニ症候群の場合、若年で乳がんと診断されることがあります。そのため、若年の乳がんの既往がある場合、BRCA1とBRCA2の遺伝学的検査で陰性であっても、リー・フラウメニ症候群の可能性は否定できません。
<リー・フラウメニ症候群の遺伝学的検査>
-
リー・フラウメニ症候群かどうかは遺伝学的検査によって調べます。TP53遺伝子に病的バリアントを持つ場合にリー・フラウメニ症候群と診断されます。
-
この遺伝子の変化は、親から子どもへ50%の確率で伝わります。また、リー・フラウメニ症候群ではTP53の病的バリアントが上の世代から受け継がれるのではなく、ご本人から突然変異で始まることもあります(TP53の病的バリアントを認めた方の7〜20%の確率です)。そのためご家族にがんと診断された方がおられなくてもリー・フラウメニ症候群を否定できません。
| まとめ:リー・フラウメニ症候群 |
|---|
|
Chapter5 ④家族性大腸腺腫症(FAP、家族性大腸ポリポーシス)
-
大腸にポリープが多発する家族性大腸腺腫症(familial adenomatous polyposis: FAP、家族性大腸ポリポーシス)があります。FAPでは、一般的に、大腸に100個以上のポリープが認められ、密生型というタイプでは大腸に1,000個以上のポリープが発生します。ポリープの数が100個に満たない場合でも、密生型に比べ、発症が遅く、ポリープの数も少ない軽症型であるattenuated FAP(AFAP)の可能性があります。
-
これまでFAPの治療は原則として外科的に全ての大腸を切除して、小腸を肛門あるいは直腸に吻合する手術が行われます(大腸全摘術)。大腸を全部取ってしまって大丈夫なのか、と思われるかもしれませんが、多くの患者さんでは排便回数は増えるものの、徐々に安定して社会復帰されています。2022年から、患者さんの状況によっては、定期的に大腸内視鏡検査を実施し、ポリープを切除する治療を保険診療で実施可能な施設もあります。
-
FAPでは、この他に十二指腸や胃に腺腫やがんが発症することもありますが、これらも早期発見であれば内視鏡的治療が可能な場合があります。また、デスモイドという腫瘤が腹部臓器を圧排するように発育することがあります。
-
FAPは APCという遺伝子に変化(病的バリアント)があることが原因であり、この変化は親から子どもへ50%の確率で受け継がれます。現在では、患者さんの血縁者に大腸内視鏡検査や遺伝学的検査を行うことで、大腸がんが発症する前にFAPの診断が可能になりました。FAPとわかれば、10〜12歳から、AFAPの場合には18〜20歳からの大腸がん検診について話し合います。
| まとめ:家族性大腸腺腫症(FAP) |
|---|
|
(詳細は専門医にご相談ください:参考文献:HFA Vasen, et al., 2008)
Chapter6 遺伝性腫瘍症候群の遺伝子検査(遺伝学的検査)
<遺伝学的検査とは>
-
遺伝学的検査は採血した検体、約7〜10mlを用いて行います。血液中の白血球細胞からDNAを抽出し、特定の遺伝子の文字の並び(塩基配列)を調べます(遺伝子は文字がたくさん並んで構成されています)。例えば遺伝性乳がん卵巣がん(HBOC)と関係しているBRCA1遺伝子では約6,000個、家族性大腸腺腫症と関係しているAPC遺伝子では約9,000個の塩基配列で構成されています。
- 遺伝学的検査では、目的とする遺伝子の塩基配列に生まれつき持っている、病気と関係する変化(病的バリアント)がないかどうかを調べます。また1つの塩基配列だけでなく、塩基が大きなブロック単位で欠けているか、あるいは重複しているかを調べることもあります。
-
遺伝学的検査の結果の解釈は、専門的な知識を必要とします。検査で見つかった配列の変化が病気の発症と関係している変化(病的バリアント)なのか、あるいは病気と関係する変化が見つからなかった場合にこの結果をどのように考えればよいかを十分に検討します。また現在の遺伝学的検査ですべての遺伝的な要因の関与が説明できるわけではなく、限界があります。
<遺伝学的検査の種類>
-
遺伝カウンセリングでご本人の病歴、家族歴を確認しながら、どの遺伝性腫瘍の可能性が考えられるか検討し、適切な遺伝学的検査についてご本人と話し合います。
- それらの情報から複数の遺伝性腫瘍が疑われる場合や、情報が少なく判断が難しい場合など、複数の遺伝性腫瘍の原因となる遺伝子を同時に調べることのできる多遺伝子パネル検査(Multigene panel testing; MGPT)をご提案することもあります。
-
遺伝学的検査は保険収載されているものと自費診療となるものがあります。
-
詳しくは遺伝カウンセリングでご相談ください。
<遺伝学的検査の特徴>
-
遺伝子の情報は、生涯変わることがありません。したがって、将来発症するがんのリスクを知っておくことで、その対策を考えることができます。
-
また、遺伝学的検査の結果は自分だけではなく、血縁者にも関係があります。家系内で最初に遺伝学的検査を受けた方が、何らかの遺伝子の変化が認められた場合には、ご両親、ごきょうだい、お子さんは50%の確率で同じ変化をもっている可能性があります。それが分かることにより、今の時点ではがんにかかっていない血縁者でも遺伝学的検査を受けて同じ変化をもっていることがわかれば、がんを発症する前から具体的に対策を立てることが可能です。
| まとめ:遺伝性腫瘍症候群の遺伝学的検査 |
|---|
|




