- HOME
- ����Ɋւ�����
- ����̎�ނɂ���
- �X������
- �i�s�X����ɑ���W�w�I����
�i�s�X����ɑ���W�w�I����
�i�s�X����ɑ���W�w�I����
�ߔN�̉��w�Ö@�̐i���ɂ��A�X���̎��Â͎�p�Ɖ��w�Ö@��g�ݍ��킹�邱�Ƃ��펯�ƂȂ��Ă��Ă��܂��B���@�ł�2000�N����A�X���؏���̏p��⏕���w�Ö@�ɐϋɓI�Ɏ��g�݁A�o���L�x�ȉ��w�Ö@�S����ɂ��A��N�P��p�ƌ������X���؏�������S�ȕ⏕���w�Ö@����Ă��܂��B
���@�̎g���ł���i�s�X���̎��Ð��ь���̂��߁A2015�N�ȍ~�A��v���ǁi�㒰�Ԗ��Ö��A�喬�A�㒰�Ԗ������A���o�����j�ւ̐Z�����^����A��U�w�I�؏��\���E���X���iBorderline resectable pancreatic cancer, BRPC�j�ɑ��āA�p�O�⏕���w�Ö@���g�ݍ��킹�āA�⏕���w�Ö@�iGEM+Nab-paclitaxel�j→�؏�→�p��⏕���w�Ö@�iS-1�j�ɂ��W�w�I���Â����{���Ă��܂��B��܂̑I���ɂ́A�L�����Ɠ����Ɉ��S�����l������K�v������A�{��܂́A�����_�ŕ���Ă����܂̒��ł��������ɑ��ď\���Ȏ�ᇏk�����ʂ����҂ł��A�S�R�[�X�̉��w�Ö@��ɔ�r�I�Z���Ԃ��X���\��w���؏����X�̔����؏������S�Ɏ{�s�\�ł���Ƃ������������Ă���܂��B���ۂɁA�{�������J�n���Ă���̐؏����͗ǍD�ŁA8���ȏ�̊��҂����S�ɐ؏��܂Ŏ{�s�\�ł���A���㎡�Ð��т̌���Ɋ�^����ƍl���Ă���܂��B���݂܂łɓ��헪��100��̎��Î��т�����A�ȑO�̐؏���s����Ɣ�ׂ�2�{�߂������������тĂ��܂��B
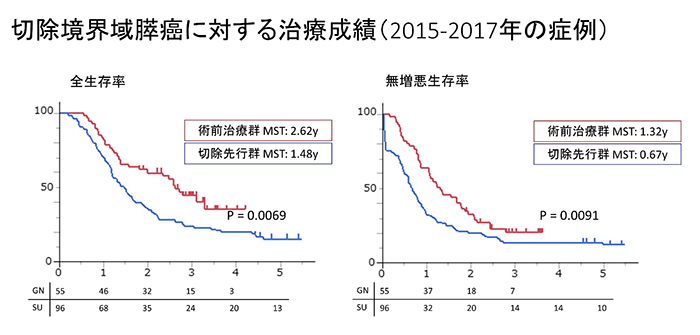
�؏��\���E���X����������ɐi�s���A���f���_�ł͐؏��s�\�ł������؏��s�\���iUnresectable pancreatic cancer�j�ƌĂт܂��B�؏��s�\���ɂ́A�X��a�����Ǐ��Ői�s���ċZ�p�I�ɐ؏��o���Ȃ�����(�Ǐ��i�s�X���FUR-LA[�X����舵���K���7��])�ƁA���u�]�ڂɂ��؏����Ă������ɂȂ�Ȃ����́i���u�]���X���FUR-M[�X����舵���K���7��]�j�ɕ�����܂��B�؏��s�\���͒��炭�L���Ȏ��Ö@���Ȃ��ƌ����Ă��܂������A�ߔN�̉��w�Ö@�̐i���ɔ����A���w�Ö@�������t�����Ď�ᇂ��k�������艓�u�]�ڂ�����������Ȃǂ��āA�؏����\�ƂȂ������҂������������Ă��Ă��܂�(Conversion�؏��Ƃ����܂��j�B���̃f�[�^�́A���f���ɐ؏��s�\�Ɛf�f����Ă��A�ŏI�I�ɐ؏��Ɏ������߂�\��������ƐM���ďW�w�I���ÂɎ��g�ފ��҂���̑傫�Ȋ�]�ƂȂ��Ă��܂��B
�܂��A�i�s�x����r�I�Ⴂ�؏��\�X���i��ᇖ��ǂւ̐Z�����Ȃ��j�̒��ɂ��A�Ĕ����X�N�̍������҂����݂��邱�Ƃ��킩���Ă��Ă��܂��B2019�N����́A��U�w�I�؏��\�X���ɕ��ނ���銳�҂�����ʂɐ��肵�A�p�O���w�Ö@ (GEM�{S-1) �����Ă��܂��B��ɍŐV�E�ŗǂƂ���鎡�Ð헪�𑁊��ɓ������A�œ���ł����X����Ɛ키���҂�����T�|�[�g���ĎQ��܂��B
�؏��s�\�X���ɑ���conversion surgery
Conversion surgery�Ƃ́H
�X���͏�����ōł��\��s�ǂȊ��̈�ł���A���f���_�Ő؏��\�ȏǗ��10�|15���Ƃ����܂�(1-3)�B�؏��s�\�iUR�j�X���ɂ́A�X�a�ς̋Ǐ��i�s��(UR-LA)�Ɖ��u�]�ڂ�L�����(UR-M)��2������AUR�Ɛf�f���ꂽ���҂���́A�������ÂƂ��Ă܂����w�Ö@���s���܂��B���������̎��_���X�������̕ۏ͂Ȃ��A���_�I�ɂ����̓I�ɂ����������ł̎��Â�]�V�Ȃ�����Ă��܂����B�ߔNFOLFIRINOX(4)��gemcitabine+nab-paclitaxel (GNP)(5)�̑䓪�ɂ��A���w�Ö@�̑t������3-4���A�Ǐ����䗦��7-8���܂Ō��サ�܂����B����ɂƂ��Ȃ��A�؏��s�\���\�ɓ]�������A "conversion surgery"�̕��}�����Ă���(6-10)�A�X�����҂���̐V������]�ƂȂ����܂��B
Conversion Surgery�ɋ��߂������
�؏��s�\��Ԃ̂���ɑ��铱�����w���Â��t�����A�؏��\�ɕς��Ƃ������Ƃ́A�ΏۂƂȂ銳�҂���͉��w�Ö@���\���t��������Ԃƌ����܂��B���̂܂܉��w�Ö@���p������Ă�����Ȃ�̗\�㉄�������҂���邽�߁Aconversion surgery�ɋ��߂�����̂�
- ���w�Ö@�̌p��������\�㉄������
- �W���I�X�؏��Ɠ����̏p��Z�����сE���S��
�ł��B���Ȃł͂���܂ŁA�؏��s�\�f�f����FOLFIRINOX��GNP���J�n�������҂���Ɋւ��āA�@��ᇂ̉摜�I�k���������邱�ƇA��ᇃ}�[�J�[�����퉻���邱�ƇB�������Â�8�����p������Ă��邱�Ƃ�conversion surgery�̌����K���Ƃ��Đf�Â��s���Ă��܂����B
Conversion surgery�̗\�㉄������
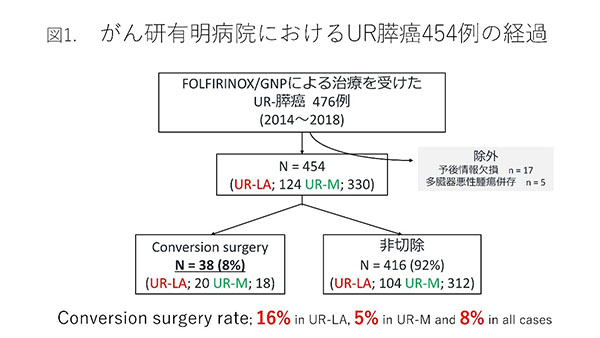
UR-LA�ɂ���UR-M�ɂ���A�������Â��\���t�������i�K�ŏ��߂Ď�p(conversion surgery)�K������������܂��BUR-LA�ł���A�������Âɂ���a���̏k��������ꖬ�ǂ̉����܂��͍����؏��Č����s����R0���\�ƂȂ邱�Ƃ��K�v�����ł���A�����Ɏ��Ê��Ԃ�ʂ��ĉ��u�]�ڂ̏o�����Ȃ����Ƃ��\�������ƂȂ�܂��BUR-M�ł��X��a�ς͋Z�p�I�ɐ؏��\�ȏǗ�������A�]�ڑ��̏����܂���ፍ�����conversion surgery�̏\�������Ƃ��Ă��܂��B���Ȃ�UR�Ɛf�f����AFOLFIRINOX��GNP�ɂ�铱�����Â���454���̊��҂���̊ώ@�����̌��ʂ��ȉ��Ɏ����܂�(10)�B
2014�N����2018�N�ɁA���@�ŏ��f����UR�X���Ɛf�f����AFFX�܂���GNP�ɂ�鎡�Â����ꂽ454��̂���UR-LA��124��AUR-M��330��ł����B�������w�Ö@�̌��ʁA38��(8%, CS�Q)��conversion surgery�Ɏ���܂���(�}1)�B���Ă�conversion�����ق�0�ł��������ォ��l����Ƃ���ł��傫�Ȋ�]�ƂȂ�܂��BConversion surgery�̓����UR-LA��20��(16%)�AUR-M18��(5%)�ł����B
454��̏p�O�����������Ă݂��Ƃ���A���������ɏd�v�Ȉ��q�͇@��ᇃ}�[�J�[(CA19-9) ���퉻�A�A���҂���̌��C��(modified Glasgow Prognostic Score = 0)�A�B�摜��̎�ᇂ̏k���A�C�p�O���Ê��Ԃ�8�����ȏ㏇���ɑ��������Ɓ@��4�_�ł����B�����4�_�����������Ő����Ȑ���w�ʉ�����ƁA454��̗\�オ���m�ɕ�����܂��i�}2�j�B
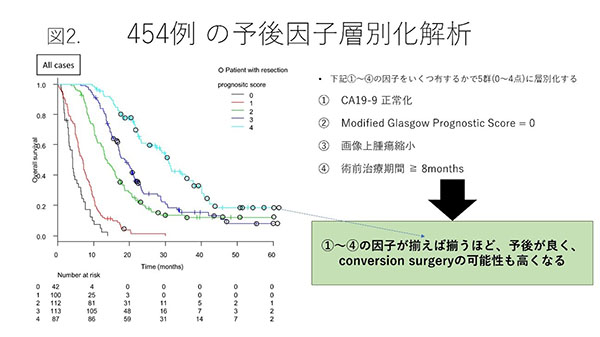
�@�`�C�̂��ׂĂ̏������������87��(score 4�_)�́A�������Ԓ����l��30.6������UR���҂���̒��ł͓��ɗ\��ǍD���Aconversion surgery�̗���20���ƍ����ł����B
����87��͓������Â������ɍs��ꂽ�Q�ɑ������邽�߁A���̒���conversion surgery �� ��؏��̐������т��r����ƁA�w��؏�(���w�Ö@�p��)�x�̕��j�ɑ���conversion surgery�̗\���悹���ʂ�����ł��܂��B�}3��87���conversion surgery �� ��؏��ŕ����������Ȑ��������܂��BUR-LA(�������Ԓ����l Not reached vs. 31.0����, P= 0.0022)�AUR-M(41.6 vs. 23.2����, P= 0.0045)�A�ǂ���̃O���[�v�ł��A�؏�(conversion surgery)�Q���L�ӂɗ\��ǍD�Ƃ������ʂł����B
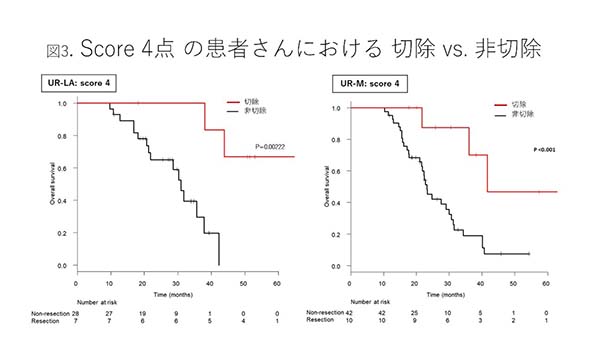
�ȏ�̃f�[�^�������āA���Ȃł͇@�`�C�̏��������낦�ΐϋɓI��conversion surgery���������A�Z�p�I�Ɉ��S�ɉ\�Ɣ��f�����A���҂ɒ�Ă�����j�Ƃ��Ă��܂��B
Conversion surgery�̈��S��
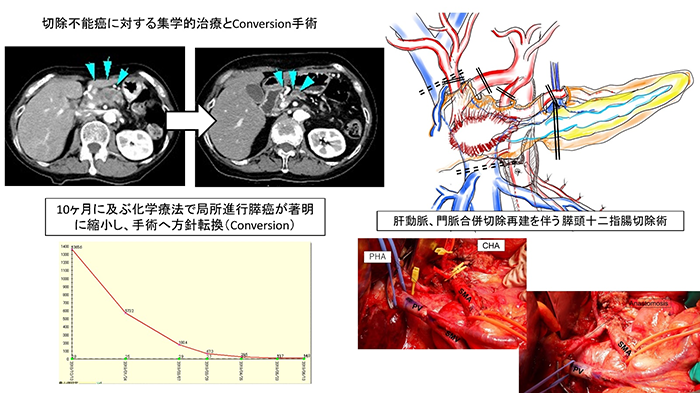
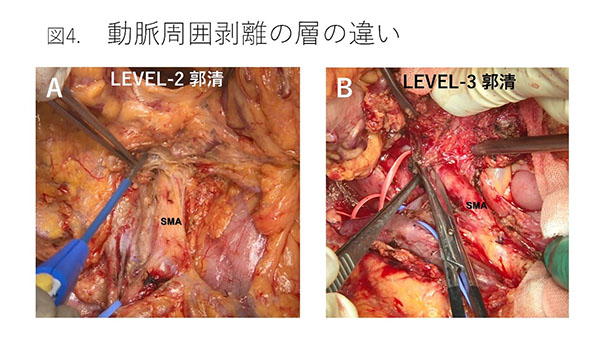
��������conversion surgery�̋@��Ă��A��p�ɂ�鍇���ǂŖ��𗎂Ƃ�����A�p��ɑ傫�Ȍ��ǂ��c���Ă͈Ӗ�������܂���BConversion surgery�Ƃ������ʂȏł��A�ʏ���X�؏��Ɠ����̈��S�������z�I�ł��BUR-LA�͒�`�ʂ�A�㒰�Ԗ�����(SMA)�܂��͕��o����(CA)��180°�ȏ�̐ڐG�܂��͒��ڐZ����L����ǗႪ�قƂ�ǂł��B�������w�Ö@���t�����Ď��ᇂ��k�����Ă��������͂̐ڐG�͎c�����邱�Ƃ������AR0�؏����������邽�߂ɂ͓������͐_�o�p�̍����؏���A���������؏��Č��Ƃ��������x�ȋZ�p���v������܂��B�������͐_�o�p�̍����؏�����X��Level-3�s���ƌĂ�(11-13)�A�n���I�̈惊���p�s���̂�(level-2)�ɔ�ׂ�Ɠ����O����I�o����w�ł̔��������߂��邽�ߓ�Փx�������Ƃ���܂��B����Level-3�s�������S�ɍs�����߂̃|�C���g�Ƃ��āA�����O���ɔM�����������ƌ�X�̓����ǂ̕ϐ��ɂ��Ǝ㉻�A��������ᎁA�p��o���ɂȂ��鋰�ꂪ���邽�߁A�����Ƃ��ĉs���ȃn�T�~�ɂ��s�I�E��I�Ȕ�����p����K�v������܂��i�}4�j�B
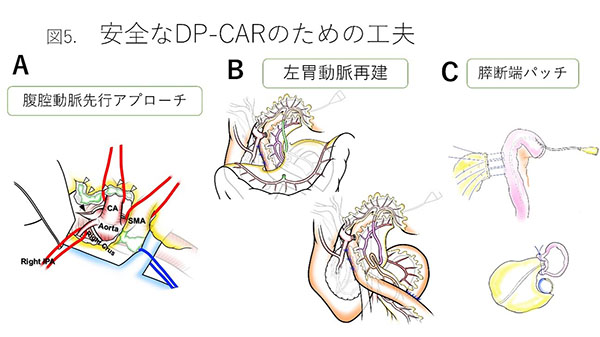
���������؏��Ɋւ��āA�ł����y���Ă����p���X�̕����ɑ��镠�o���������؏����X�̔����؏��p(DP-CAR)�ł����A�ߔN���X�����Ǐ��i�s���ɑ��āA�̓��������؏����X���\��w���؏�(PD-CHAR)�̎��{�������Ă��܂��B���@��DP-CAR�́A�@���o������s�A�v���[�`�ƌ����Ւf�ɂ��o���ʂ��y���A�A���ݓ��������܂��͍Č��ɂ��p��̑��틕�������ǂ��ŏ����A�B�X�f�[�ɑ���p�b�`�ɂ���Xᑊ֘A�����ǂ�\�h����H�v��W�������A���݂܂�67����p�֘A���S�Ȃ����{���Ă��܂��B�i�}5�j(14-16)�B
�܂��A��ʓI�ɂ͓������͊s���⓮�������؏��ɔ��������_�o�p�̐؏��ŁA�p��_�o������������QOL�̒ቺ��p��⏕�Ö@�̓����s�ǂȂǂ����O����Ă��܂������A�K�Ȏ~����̎g�p�ɂ��A�_�o�������̓R���g���[�����\�ƂȂ�܂��B���Ȃł͐_�o���������^�����_�ŁA�A�w���`���L��0.9ml 3× ���H�O�^������X�^�[�g���܂��B���l���������y�����A�։�1��3��ȓ��ɂȂ�܂ŏ��X�ɑQ������V���v�����L���ȕ��p�@�ł�(11)�B���Ȃł̓A�w���`���L�̌n���I�Ȏg�p�ɂ��A�������͊s���⓮�������؏��ɂ���Đ_�o���������������ꍇ�ł��A�p�㍇���Ǘ�����э݉@�����ɂ͐_�o�������Ȃ��̌Q�ƗL�Ӎ��Ȃ��AS-1�ɂ��p��⏕�Ö@��������9���̊��҂���Ŏ��{����Ă��܂�(17)�B
������
�W�w�I���Â�Conversion surgery�͐i�s�X����L���銳�҂���̊�]�̌��ƂȂ��Ă��܂��B�������O��Ƃ��āA�p��̊���QOL��⏕�Ö@�̎��{�܂Ŕz���������S���̊m�ہA�p�㍇���ǁi���ɐ_�o�������j�̍ŏ������K�v�ł���A�L�x�Ȏ�p�o����L����{�݁E�X���O�Ȉ�̉��Ŏ�p���邱�Ƃ��d�v�ł��B
�i���ӁE���z��j
�i�Q�l�����j
- Egawa S, Toma H, Ohigashi H, Okusaka T, Nakao A, Hatori T, et al. Japan Pancreatic Cancer Registry; 30th year anniversary: Japan Pancreas Society. Pancreas. 2012;41(7):985-92.
- Rahib L, Smith BD, Aizenberg R, Rosenzweig AB, Fleshman JM, Matrisian LM. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer research. 2014;74(11):2913-21.
- Vincent A, Herman J, Schulick R, Hruban RH, Goggins M. Pancreatic cancer. Lancet. 2011;378(9791):607-20.
- Conroy T, Desseigne F, Ychou M, Bouche O, Guimbaud R, Becouarn Y, et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. The New England journal of medicine. 2011;364(19):1817-25.
- Von Hoff DD, Ervin T, Arena FP, Chiorean EG, Infante J, Moore M, et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. The New England journal of medicine. 2013;369(18):1691-703.
- Del Chiaro M, Valente R, Arnelo U. Neoadjuvant Treatment in Locally Advanced and Borderline Resectable Pancreatic Cancer vs Primary Resectable Pancreatic Cancer. JAMA surgery. 2017;152(11):1057.
- Gemenetzis G, Groot VP, Blair AB, Laheru DA, Zheng L, Narang AK, et al. Survival in Locally Advanced Pancreatic Cancer After Neoadjuvant Therapy and Surgical Resection. Annals of surgery. 2019;270(2):340-7.
- Perri G, Prakash L, Qiao W, Varadhachary GR, Wolff R, Fogelman D, et al. Response and Survival Associated With First-line FOLFIRINOX vs Gemcitabine and nab-Paclitaxel Chemotherapy for Localized Pancreatic Ductal Adenocarcinoma. JAMA surgery. 2020;155(9):832-9.
- Truty MJ, Kendrick ML, Nagorney DM, Smoot RL, Cleary SP, Graham RP, et al. Factors Predicting Response, Perioperative Outcomes, and Survival Following Total Neoadjuvant Therapy for Borderline/Locally Advanced Pancreatic Cancer. Annals of surgery. 2021;273(2):341-9.
- Ushida Y, Inoue Y, Oba A, Mie T, Ito H, Ono Y, et al. Optimizing Indications for Conversion Surgery Based on Analysis of 454 Consecutive Japanese Cases with Unresectable Pancreatic Cancer Who Received Modified FOLFIRINOX or Gemcitabine Plus Nab-paclitaxel: A Single-Center Retrospective Study. Annals of surgical oncology. 2022.
- Inoue Y, Saiura A, Oba A, Kawakatsu S, Ono Y, Sato T, et al. Optimal Extent of Superior Mesenteric Artery Dissection during Pancreaticoduodenectomy for Pancreatic Cancer: Balancing Surgical and Oncological Safety. J Gastrointest Surg. 2019;23(7):1373-83.
- Inoue Y, Saiura A, Takahashi Y. A Novel Classification and Staged Approach for Dissection Along the Celiac and Hepatic Artery During Pancreaticoduodenectomy. World J Surg. 2018;42(9):2963-7.
- Inoue Y, Saiura A, Yoshioka R, Ono Y, Takahashi M, Arita J, et al. Pancreatoduodenectomy With Systematic Mesopancreas Dissection Using a Supracolic Anterior Artery-first Approach. Ann Surg. 2015;262(6):1092-101.
- Inoue Y, Saiura A, Sato T, Oba A, Ono Y, Mise Y, et al. Details and Outcomes of Distal Pancreatectomy with Celiac Axis Resection Preserving the Left Gastric Arterial Flow. Annals of surgical oncology. 2021;28(13):8283-94.
- Oba A, Inoue Y, Sato T, Ono Y, Mise Y, Ito H, et al. Impact of indocyanine green-fluorescence imaging on distal pancreatectomy with celiac axis resection combined with reconstruction of the left gastric artery. HPB (Oxford). 2019;21(5):619-25.
- Sato T, Inoue Y, Takahashi Y, Mise Y, Ishizawa T, Tanakura K, et al. Distal Pancreatectomy with Celiac Axis Resection Combined with Reconstruction of the Left Gastric Artery. J Gastrointest Surg. 2017;21(5):910-7.
- Kuroki N, Ono Y, Sato T, Inoue Y, Oba A, Ito H, et al. Long-Term Outcome of Patients with Postoperative Refractory Diarrhea After Tailored Nerve Plexus Dissection Around the Major Visceral Arteries During Pancreatoduodenectomy for Pancreatic Cancer. World J Surg. 2022.



